Baricitinib de Eli Lilly e Incyte recibe una AUE de la FDA para uso como monoterapia en pacientes hospitalizados de COVID-19 que requieren oxígeno
|
Por el equipo editorial de LabMedica en español Actualizado el 10 Aug 2021 |

Imagen: Baricitinib (Fotografía cortesía de Eli Lilly and Company)
La Administración de Medicamentos y Alimentos de los EUA (FDA) amplió la autorización de uso de emergencia (AUE) para el baricitinib, un inhibidor de JAK1/JAK2 licenciado a Eli Lilly and Company (Indianápolis, Ind, EUA) por Incyte (Wilmington, DE, EUA), para permitir el tratamiento con o sin el medicamento antiviral remdesivir de Gilead Sciences (Foster City, CA, EUA).
Anteriormente, la AUE estaba restringida para uso solo en combinación con remdesivir y ahora prevé el uso de baricitinib para el tratamiento de la COVID-19 en adultos hospitalizados y pacientes pediátricos de dos años o mayores que requieren oxígeno suplementario, ventilación mecánica no invasiva o invasiva u oxigenación por membrana extracorpórea (ECMO). El baricitinib es un inhibidor de la Janus quinasa, que bloquea la actividad de una o más de una familia específica de enzimas, interfiriendo con la vía que conduce a la inflamación. El baricitinib es una tableta oral recetada que está aprobada por la FDA (y se vende con la marca Olumiant) para el tratamiento de la artritis reumatoide activa de moderada a grave.
La FDA basó su decisión en los datos del estudio de fase 3 COV-BARRIER, aleatorizado, doble ciego y controlado con placebo, de pacientes hospitalizados que comparó el tratamiento con 4 mg de baricitinib una vez al día más atención estándar, versus placebo más atención estándar. Los pacientes podían permanecer en el estándar de atención de fondo, según lo definido por las pautas locales, que incluyen antipalúdicos, antivirales, corticosteroides y/o azitromicina. Las terapias más utilizadas fueron los corticosteroides (79% de los pacientes, principalmente dexametasona) y remdesivir (19% de los pacientes). Si bien el criterio de valoración principal compuesto de COV-BARRIER, que se definió como una diferencia en la proporción estimada de participantes que progresaron a la ventilación no invasiva, incluida la ventilación de alto flujo de oxígeno o la ventilación mecánica invasiva (incluida la ECMO) o la muerte el día 28, no cumplió con la significancia estadística, los pacientes tratados con baricitinib (27,8%) tenían menos probabilidades que los que recibieron atención estándar (30,5%) de progresar a ventilación o muerte. Un criterio de valoración secundario clave preespecificado mostró que el baricitinib, además del estándar de atención, redujo significativamente el riesgo de muerte en un 39 por ciento para el día 28 en comparación con el estándar de atención solo.
La AUE inicial se basó en datos del ensayo de tratamiento adaptativo COVID-19 (ACTT-2), un estudio aleatorizado, doble ciego, controlado con placebo, para evaluar la eficacia y seguridad de baricitinib en combinación con remdesivir versus placebo con remdesivir en pacientes hospitalizados con o sin requisitos de oxígeno realizado por el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID), parte de los Institutos Nacionales de Salud (NIH). Los datos que respaldan la AUE inicial incluyeron el criterio de valoración principal de la mediana del tiempo hasta la recuperación, que fue de siete días para baricitinib más remdesivir en comparación con ocho días para placebo más remdesivir. Los criterios de valoración secundarios incluyeron la proporción de pacientes que murieron o progresaron a ventilación no invasiva/alto flujo de oxígeno o ventilación mecánica invasiva el día 29, que fue menor con baricitinib más remdesivir (23%) en comparación con placebo más remdesivir (28%), y la proporción de pacientes que murieron el día 29 fue del 4,7% (24/515) para baricitinib más remdesivir versus 7,1% (37/518) para placebo más remdesivir.
“El baricitinib en combinación con remdesivir ya ha proporcionado a muchas personas una opción de tratamiento que podría ayudar a prevenir la progresión a la ventilación o la muerte y aumentar la velocidad de recuperación para ciertos pacientes hospitalizados con COVID-19 bajo su uso actualmente autorizado”, dijo Ilya Yuffa, vicepresidente senior y presidente de Lilly Bio-Medicines. “La acción de la FDA de hoy brinda a los médicos opciones de regímenes de tratamiento adicionales para que el baricitinib continúe satisfaciendo las necesidades médicas urgentes que plantea esta pandemia. Basado en el creciente cuerpo de evidencia, confiamos en el potencial del baricitinib como un tratamiento importante para el paciente hospitalizado con COVID-19 que requieren oxígeno suplementario”.
“Los datos clínicos recientes han ayudado a mejorar nuestra comprensión del papel potencial del baricitinib en el tratamiento de ciertos pacientes hospitalizados con COVID-19 y la AUE ampliada representa un paso crítico en la lucha contra la pandemia”, dijo E. Wesley Ely, MD, MPH, profesor de medicina y codirector del Centro de Enfermedades Críticas, Disfunción Cerebral y Supervivencia (CIBS) en el Centro Médico de la Universidad de Vanderbilt y codirector principal de COV-BARRIER.
Enlace relacionado:
Eli Lilly and Company
Incyte
Gilead Sciences
Anteriormente, la AUE estaba restringida para uso solo en combinación con remdesivir y ahora prevé el uso de baricitinib para el tratamiento de la COVID-19 en adultos hospitalizados y pacientes pediátricos de dos años o mayores que requieren oxígeno suplementario, ventilación mecánica no invasiva o invasiva u oxigenación por membrana extracorpórea (ECMO). El baricitinib es un inhibidor de la Janus quinasa, que bloquea la actividad de una o más de una familia específica de enzimas, interfiriendo con la vía que conduce a la inflamación. El baricitinib es una tableta oral recetada que está aprobada por la FDA (y se vende con la marca Olumiant) para el tratamiento de la artritis reumatoide activa de moderada a grave.
La FDA basó su decisión en los datos del estudio de fase 3 COV-BARRIER, aleatorizado, doble ciego y controlado con placebo, de pacientes hospitalizados que comparó el tratamiento con 4 mg de baricitinib una vez al día más atención estándar, versus placebo más atención estándar. Los pacientes podían permanecer en el estándar de atención de fondo, según lo definido por las pautas locales, que incluyen antipalúdicos, antivirales, corticosteroides y/o azitromicina. Las terapias más utilizadas fueron los corticosteroides (79% de los pacientes, principalmente dexametasona) y remdesivir (19% de los pacientes). Si bien el criterio de valoración principal compuesto de COV-BARRIER, que se definió como una diferencia en la proporción estimada de participantes que progresaron a la ventilación no invasiva, incluida la ventilación de alto flujo de oxígeno o la ventilación mecánica invasiva (incluida la ECMO) o la muerte el día 28, no cumplió con la significancia estadística, los pacientes tratados con baricitinib (27,8%) tenían menos probabilidades que los que recibieron atención estándar (30,5%) de progresar a ventilación o muerte. Un criterio de valoración secundario clave preespecificado mostró que el baricitinib, además del estándar de atención, redujo significativamente el riesgo de muerte en un 39 por ciento para el día 28 en comparación con el estándar de atención solo.
La AUE inicial se basó en datos del ensayo de tratamiento adaptativo COVID-19 (ACTT-2), un estudio aleatorizado, doble ciego, controlado con placebo, para evaluar la eficacia y seguridad de baricitinib en combinación con remdesivir versus placebo con remdesivir en pacientes hospitalizados con o sin requisitos de oxígeno realizado por el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID), parte de los Institutos Nacionales de Salud (NIH). Los datos que respaldan la AUE inicial incluyeron el criterio de valoración principal de la mediana del tiempo hasta la recuperación, que fue de siete días para baricitinib más remdesivir en comparación con ocho días para placebo más remdesivir. Los criterios de valoración secundarios incluyeron la proporción de pacientes que murieron o progresaron a ventilación no invasiva/alto flujo de oxígeno o ventilación mecánica invasiva el día 29, que fue menor con baricitinib más remdesivir (23%) en comparación con placebo más remdesivir (28%), y la proporción de pacientes que murieron el día 29 fue del 4,7% (24/515) para baricitinib más remdesivir versus 7,1% (37/518) para placebo más remdesivir.
“El baricitinib en combinación con remdesivir ya ha proporcionado a muchas personas una opción de tratamiento que podría ayudar a prevenir la progresión a la ventilación o la muerte y aumentar la velocidad de recuperación para ciertos pacientes hospitalizados con COVID-19 bajo su uso actualmente autorizado”, dijo Ilya Yuffa, vicepresidente senior y presidente de Lilly Bio-Medicines. “La acción de la FDA de hoy brinda a los médicos opciones de regímenes de tratamiento adicionales para que el baricitinib continúe satisfaciendo las necesidades médicas urgentes que plantea esta pandemia. Basado en el creciente cuerpo de evidencia, confiamos en el potencial del baricitinib como un tratamiento importante para el paciente hospitalizado con COVID-19 que requieren oxígeno suplementario”.
“Los datos clínicos recientes han ayudado a mejorar nuestra comprensión del papel potencial del baricitinib en el tratamiento de ciertos pacientes hospitalizados con COVID-19 y la AUE ampliada representa un paso crítico en la lucha contra la pandemia”, dijo E. Wesley Ely, MD, MPH, profesor de medicina y codirector del Centro de Enfermedades Críticas, Disfunción Cerebral y Supervivencia (CIBS) en el Centro Médico de la Universidad de Vanderbilt y codirector principal de COV-BARRIER.
Enlace relacionado:
Eli Lilly and Company
Incyte
Gilead Sciences
Últimas COVID-19 noticias
- Inmunosensor nuevo allana el camino para pruebas rápidas POC para COVID-19 y enfermedades infecciosas emergentes
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Prueba nueva COVID + Influenza + VSR ayudará a estar preparados para la ‘tripledemia’
- IA elimina las conjeturas de las pruebas de flujo lateral
- Prueba de antígeno del SARS-CoV-2 más rápida, jamás diseñada, permite realizar pruebas de COVID-19 no invasivas en cualquier entorno
- Pruebas rápidas de antígeno detectan las variantes ómicron, delta del SARS-CoV-2
- Prueba en sangre realizada durante la infección inicial predice el riesgo de COVID prolongada
- Investigadores afirman que hay que crear “reservistas” de laboratorio para responder más rápidamente a la próxima pandemia
- Estudio encuentra que los profesionales sanitarios mostraron mayor interés en tecnologías POC durante la pandemia
- Plataforma de análisis de bajo costo para la COVID-19 combina sensibilidad de la PCR y velocidad de pruebas de antígeno
- Prueba de sangre por punción digital identifica inmunidad a la COVID-19
- Kit de prueba rápida determina inmunidad contra la COVID-19 y sus variantes
Canales
Química Clínica
ver canal
Herramienta química a nanoescala 'brillantemente luminosa' mejora detección de enfermedades
Miles de moléculas brillantes disponibles comercialmente, conocidas como fluoróforos, se utilizan comúnmente en imágenes médicas, detección de enfermedades, marcado... Más
Prueba de detección portátil económica transforma detección de enfermedades renales
Millones de personas padecen enfermedad renal, que a menudo permanece sin diagnosticar hasta que alcanza una etapa crítica. Esta epidemia silenciosa no solo disminuye la calidad de vida de los afectados,... MásDiagnóstico Molecular
ver canal
Prueba de biomarcadores sanguíneos podría detectar predisposición genética al Alzheimer
Nuevos medicamentos para la enfermedad de Alzheimer, la forma más común de demencia, están ahora disponibles. Estos tratamientos, conocidos como "anticuerpos amiloides",... Más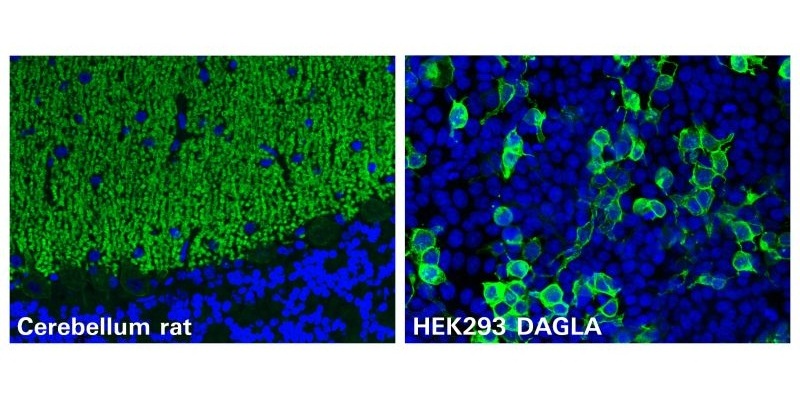
Se descubre nuevo autoanticuerpo contra DAGLA en cerebelitis
Las ataxias cerebelosas autoinmunes son trastornos muy incapacitantes que se caracterizan por una disminución de la habilidad para coordinar el movimiento muscular. Los autoanticuerpos cerebelosos... MásHematología
ver canal
Nuevo sistema de puntuación predice riesgo de cáncer a partir de un trastorno sanguíneo común
La citopenia clonal de significado incierto (CCSI) es un trastorno sanguíneo común en adultos mayores, caracterizado por mutaciones en las células sanguíneas y un recuento ... Más
Prueba prenatal no invasiva para determinar estado RhD del feto es 100 % precisa
En los Estados Unidos, aproximadamente el 15 % de las embarazadas son RhD negativas. Sin embargo, en aproximadamente el 40 % de estos casos, el feto también es RhD negativo, lo que hace innecesaria la... MásInmunología
ver canal
Prueba de células madre predice resultado del tratamiento en cáncer de ovario resistente al platino
El cáncer de ovario epitelial suele responder inicialmente a la quimioterapia, pero con el tiempo, el tumor desarrolla resistencia a la terapia, lo que provoca su recrecimiento. Esta resistencia... Más
Análisis de sangre con aprendizaje automático predice respuesta a inmunoterapia en pacientes con linfoma
La terapia de células T con receptores de antígenos quiméricos (CAR) se ha convertido en uno de los avances recientes más prometedores en el tratamiento de los cánceres... MásMicrobiología
ver canal
Dispositivo portátil ofrece resultados de tuberculosis económico y rápido
La tuberculosis (TB) sigue siendo la enfermedad infecciosa más mortal a nivel mundial, afectando a aproximadamente 10 millones de personas al año. En 2021, alrededor de 4,2 millones de casos... Más
Método basado en IA mejora diagnóstico de infecciones resistentes a fármacos
Las infecciones resistentes a los medicamentos, en particular las causadas por bacterias mortales como la tuberculosis y el estafilococo, se están convirtiendo rápidamente en una emergencia... MásPatología
ver canal
Nuevo método basado en aprendizaje automático detecta contaminación microbiana en cultivos celulares
La terapia celular tiene un gran potencial en el tratamiento de enfermedades como el cáncer, las enfermedades inflamatorias y los trastornos degenerativos crónicos mediante la manipulación o el reemplazo... Más
Nuevo método con corrección de errores detecta cáncer únicamente en muestras de sangre
La tecnología de biopsia líquida, que se basa en análisis de sangre para la detección temprana del cáncer y el seguimiento de la carga oncológica en los pacientes,... MásTecnología
ver canal
Tecnología de microchip desechable podría detectar selectivamente VIH en muestras de sangre completa
A finales de 2023, aproximadamente 40 millones de personas en todo el mundo vivían con VIH, y alrededor de 630.000 personas murieron por enfermedades relacionadas con el sida ese mismo año.... Más
Dispositivo microfluídico Dolor en un Chip determina tipos de dolor crónico desde muestras de sangre
El dolor crónico es una afección generalizada que sigue siendo difícil de controlar, y los métodos clínicos existentes para su tratamiento se basan en gran medida en... MásIndustria
ver canal
Cepheid y Oxford Nanopore se unen para desarrollar soluciones con secuenciación automatizada
Cepheid (Sunnyvale, CA, EUA), una empresa líder en diagnóstico molecular, y Oxford Nanopore Technologies (Oxford, Reino Unido), la empresa detrás de una nueva generación de... Más








.jpg)