Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
Actualizado el 01 Dec 2022
CRISPR-Cas es versátil: además de los controvertidos organismos genéticamente modificados (OGM), creados a través de la edición de genes, varios estudios científicos nuevos utilizan diferentes ortólogos de la proteína efectora ‘Cas’ para detectar ácidos nucleicos como el ADN o el ARN. Ahora, un grupo de investigadores introdujo un chip multiplexado de microfluidos para la medición simultánea de la carga viral en hisopos nasales y (si corresponde) los niveles de antibióticos en sangre de pacientes con COVID-19. El biosensor para la detección sin amplificación de ácido nucleico del ARN del SARS-CoV-2 fue desarrollado por investigadores de la Universidad de Friburgo (Baden-Württemberg, Alemania).
El lanzamiento al mercado de kits de prueba rápida de antígenos ha cambiado significativamente la forma en que la sociedad maneja los efectos de la pandemia: las personas que sospechan una infección por SARS-CoV-2 ahora se pueden hacer la prueba en casa con kits que están disponibles en la mayoría de las farmacias y supermercados, en lugar de tener que hacer una cita, muchas veces difícil de conseguir, para la prueba PCR, que requiere de uno a tres días adicionales para recibir el resultado. Sin embargo, esta conveniencia se paga con la sensibilidad de la prueba. Este problema se hizo flagrantemente evidente durante la ola de infecciones del invierno pasado, cuando los “dispositivos de flujo lateral” con frecuencia fallaron en detectar infecciones con la variante ómicron hasta después de la aparición de los síntomas.

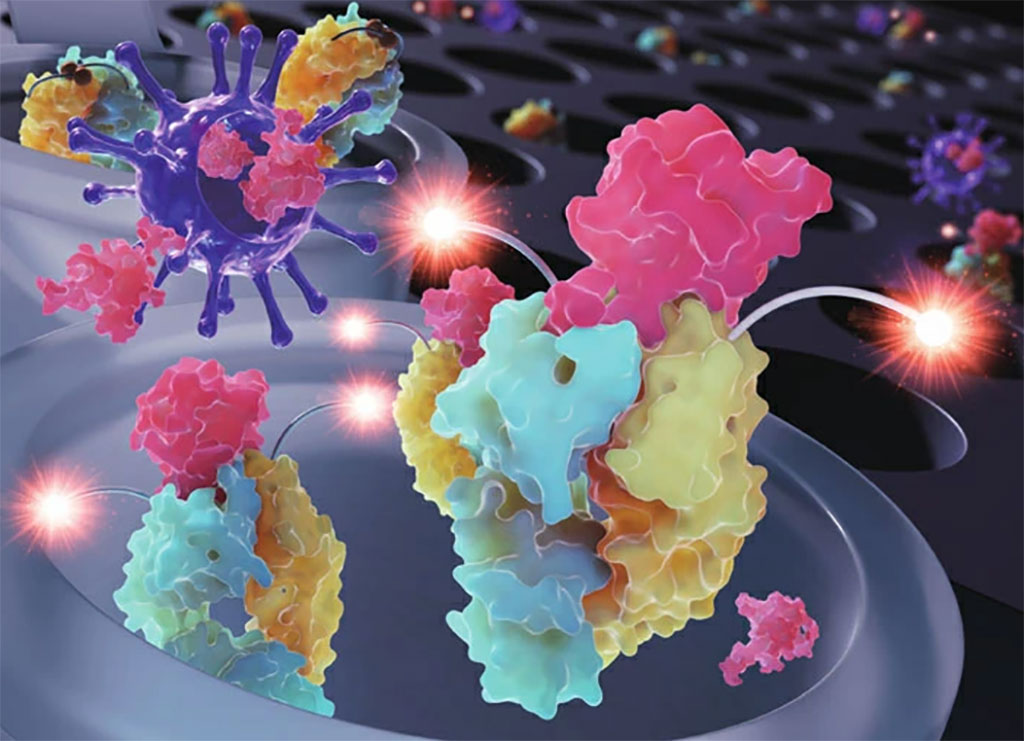
Una alternativa es una prueba COVID-19 con tecnología CRISPR. De manera similar a las pruebas rápidas realizadas en el hogar o en los centros de pruebas, se agrega una solución de muestra de un hisopo nasal u oral a una mezcla de reacción. Sin embargo, a diferencia de estas pruebas de antígenos virales, CRISPR, como la rt-qPCR, analiza la muestra del paciente en busca de secuencias de ARN características del SARS-CoV-2. Si la muestra contiene el fragmento de ARN de interés, la proteína efectora (Cas13a) se activa y escinde el ARN informador proporcionado dentro de la mezcla de reacción. La ausencia de un reportero intacto crea una relación inversamente proporcional a la abundancia de ARN viral dentro de la muestra, que luego se analiza en una lectura electroquímica (las densidades de corriente bajas indican una carga viral alta).
A la luz de las decisiones recientes de varios estados federales de suspender los requisitos de aislamiento para las personas que dieron positivo en la prueba de COVID-19, las oportunidades de pruebas confiables, sensibles y rápidas volverán a ganar importancia dentro de la tarea de manejar adecuadamente las oleadas recurrentes de infecciones. Esto último también coincidirá inevitablemente con la hospitalización de pacientes con síntomas graves y progresión de la enfermedad. Aquí es donde entra en juego otra característica del chip microfluídico: la combinación de los ensayos CRISPR con la detección de antibióticos ß-lactámicos. Los pacientes con COVID-19 a menudo adquieren coinfecciones bacterianas que luego se tratan con antibióticos de amplio espectro como amoxicilina, ampicilina o piperacilina. Encontrar y mantener la dosis correcta y personalizada es crucial para garantizar el éxito del tratamiento y reducir la aparición de cepas resistentes. El sensor propuesto podría facilitar el tratamiento de estos problemas mediante el control simultáneo de la carga viral y los niveles de antibióticos en sangre.
“La compensación entre la sensibilidad y el tiempo de respuesta del resultado podría resolverse con nuestro método”, dijo Midori Johnston, primera autora del estudio.
“Nuestro sistema, por lo tanto, omite la amplificación del ácido nucleico y es flexiblemente adaptable a nuevas mutaciones clínicamente relevantes del virus mientras emplea, exclusivamente, reactivos económicos, no tóxicos y estables en almacenamiento, así como una configuración de medición portátil”, explicó el ingeniero de microsistemas, el Dr. Can Dincer del Departamento de Ingeniería de Microsistemas de la Universidad de Friburgo, quien dirigió el grupo de investigación.
Enlaces relacionados:
Universidad de Friburgo