Vacuna de Pfizer-BioNTech contra la COVID-19 se convierte en la primera en recibir la Autorización para Uso en Emergencias
|
Por el equipo editorial de LabMedica en español Actualizado el 15 Dec 2020 |
Ilustración
La Administración de Alimentos y Medicamentos de EUA (FDA) autorizó el uso de emergencia de la vacuna de ARNm, BNT162b2 de Pfizer Inc. (Nueva York, NY, EUA) y Biopharmaceutical New Technologies (BioNTech Maguncia, Alemania), lo que marca la primera autorización histórica en EUA de una vacuna para prevenir la COVID-19.
La vacuna quedó autorizada bajo una Autorización para Uso en Emergencias (AUE), mientras que Pfizer y BioNTech recopilan datos adicionales y se preparan para presentar una solicitud de licencia de biológicos (BLA) planificada, ante la FDA, para una posible aprobación regulatoria completa en 2021. La FDA basó su decisión en la totalidad de la evidencia científica compartida por las empresas, incluidos los datos de un estudio clínico fundamental de fase 3 anunciado en noviembre y publicado en la revista The New England Journal of Medicine.
Los datos de la Fase 3 demostraron una tasa de eficacia de la vacuna del 95% en participantes sin infección previa por SARS-CoV-2 (primer objetivo primario) y también en participantes con y sin infección previa por SARS-CoV-2 (segundo objetivo primario), en cada caso medido siete días después de la segunda dosis. El Comité de Monitoreo de Datos del estudio no ha informado de ningún problema de seguridad serio relacionado con la vacuna. La eficacia fue constante según la edad, el género, la raza y la etnia. Todos los participantes del ensayo continuarán en seguimiento para evaluar la protección y seguridad a largo plazo durante dos años adicionales después de su segunda dosis.
En julio de 2020, Pfizer y BioNTech anunciaron un acuerdo con el HHS y el Departamento de Defensa para cumplir con el objetivo del programa Operación Warp Speed, del gobierno de EUA, de administrar dosis de una vacuna para la COVID-19. Con la vacuna autorizada para uso de emergencia en los EUA, las empresas comenzarán a aplicar las primeras dosis en los EUA de inmediato, y se espera que la aplicación de la vacuna se complete en 2021.
“El propósito de Pfizer son los avances que cambian la vida de los pacientes, y en nuestros 171 años de historia nunca ha habido una necesidad más urgente de un avance que hoy, con cientos de miles de personas que continúan sufriendo de COVID-19”, dijo Albert Bourla. Presidente y Director Ejecutivo de Pfizer. “Como empresa estadounidense, la noticia de hoy es un gran orgullo y una gran alegría porque Pfizer superó el desafío de desarrollar una vacuna que tenga el potencial de ayudar a poner fin a esta devastadora pandemia. Hemos trabajado incansablemente para hacer posible lo imposible, firmes en nuestra creencia de que la ciencia vencerá”.
“Fundamos BioNTech para desarrollar nuevas tecnologías y medicamentos que utilizan todo el potencial del sistema inmunológico para combatir enfermedades graves”, dijo Ugur Sahin, M.D., director ejecutivo y cofundador de BioNTech. “Hoy estamos un paso más cerca de nuestra visión. Creemos que la Autorización para Uso en Emergencias de hoy y la posterior distribución de nuestra vacuna, que ha demostrado una tasa de eficacia del 95% y un perfil de seguridad favorable, ayudarán a salvar vidas en los Estados Unidos y podrían acelerar el regreso a la normalidad”.
“La autorización de la FDA para uso en emergencias de la primera vacuna contra la COVID-19 es un hito importante en la lucha contra esta pandemia devastadora que ha afectado a tantas familias en los Estados Unidos y en todo el mundo”, dijo el comisionado de la FDA, Stephen M. Hahn, MD. “La acción de hoy es posterior a un proceso de revisión abierto y transparente que incluyó aportes de científicos independientes y expertos en salud pública y una evaluación exhaustiva por parte de los científicos de carrera de la agencia para garantizar que esta vacuna cumpla con los estándares científicos rigurosos de la FDA para la seguridad, eficacia y calidad de fabricación necesarias para respaldar la autorización de uso en emergencias. El trabajo incansable para desarrollar una nueva vacuna para prevenir esta enfermedad nueva, grave y potencialmente mortal, en un período de tiempo acelerado después de su aparición, es un verdadero testimonio de la innovación científica y la colaboración público-privada en todo el mundo”.
Enlace relacionado:
Biopharmaceutical New Technologies
La vacuna quedó autorizada bajo una Autorización para Uso en Emergencias (AUE), mientras que Pfizer y BioNTech recopilan datos adicionales y se preparan para presentar una solicitud de licencia de biológicos (BLA) planificada, ante la FDA, para una posible aprobación regulatoria completa en 2021. La FDA basó su decisión en la totalidad de la evidencia científica compartida por las empresas, incluidos los datos de un estudio clínico fundamental de fase 3 anunciado en noviembre y publicado en la revista The New England Journal of Medicine.
Los datos de la Fase 3 demostraron una tasa de eficacia de la vacuna del 95% en participantes sin infección previa por SARS-CoV-2 (primer objetivo primario) y también en participantes con y sin infección previa por SARS-CoV-2 (segundo objetivo primario), en cada caso medido siete días después de la segunda dosis. El Comité de Monitoreo de Datos del estudio no ha informado de ningún problema de seguridad serio relacionado con la vacuna. La eficacia fue constante según la edad, el género, la raza y la etnia. Todos los participantes del ensayo continuarán en seguimiento para evaluar la protección y seguridad a largo plazo durante dos años adicionales después de su segunda dosis.
En julio de 2020, Pfizer y BioNTech anunciaron un acuerdo con el HHS y el Departamento de Defensa para cumplir con el objetivo del programa Operación Warp Speed, del gobierno de EUA, de administrar dosis de una vacuna para la COVID-19. Con la vacuna autorizada para uso de emergencia en los EUA, las empresas comenzarán a aplicar las primeras dosis en los EUA de inmediato, y se espera que la aplicación de la vacuna se complete en 2021.
“El propósito de Pfizer son los avances que cambian la vida de los pacientes, y en nuestros 171 años de historia nunca ha habido una necesidad más urgente de un avance que hoy, con cientos de miles de personas que continúan sufriendo de COVID-19”, dijo Albert Bourla. Presidente y Director Ejecutivo de Pfizer. “Como empresa estadounidense, la noticia de hoy es un gran orgullo y una gran alegría porque Pfizer superó el desafío de desarrollar una vacuna que tenga el potencial de ayudar a poner fin a esta devastadora pandemia. Hemos trabajado incansablemente para hacer posible lo imposible, firmes en nuestra creencia de que la ciencia vencerá”.
“Fundamos BioNTech para desarrollar nuevas tecnologías y medicamentos que utilizan todo el potencial del sistema inmunológico para combatir enfermedades graves”, dijo Ugur Sahin, M.D., director ejecutivo y cofundador de BioNTech. “Hoy estamos un paso más cerca de nuestra visión. Creemos que la Autorización para Uso en Emergencias de hoy y la posterior distribución de nuestra vacuna, que ha demostrado una tasa de eficacia del 95% y un perfil de seguridad favorable, ayudarán a salvar vidas en los Estados Unidos y podrían acelerar el regreso a la normalidad”.
“La autorización de la FDA para uso en emergencias de la primera vacuna contra la COVID-19 es un hito importante en la lucha contra esta pandemia devastadora que ha afectado a tantas familias en los Estados Unidos y en todo el mundo”, dijo el comisionado de la FDA, Stephen M. Hahn, MD. “La acción de hoy es posterior a un proceso de revisión abierto y transparente que incluyó aportes de científicos independientes y expertos en salud pública y una evaluación exhaustiva por parte de los científicos de carrera de la agencia para garantizar que esta vacuna cumpla con los estándares científicos rigurosos de la FDA para la seguridad, eficacia y calidad de fabricación necesarias para respaldar la autorización de uso en emergencias. El trabajo incansable para desarrollar una nueva vacuna para prevenir esta enfermedad nueva, grave y potencialmente mortal, en un período de tiempo acelerado después de su aparición, es un verdadero testimonio de la innovación científica y la colaboración público-privada en todo el mundo”.
Enlace relacionado:
Biopharmaceutical New Technologies
Últimas COVID-19 noticias
- Inmunosensor nuevo allana el camino para pruebas rápidas POC para COVID-19 y enfermedades infecciosas emergentes
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Prueba nueva COVID + Influenza + VSR ayudará a estar preparados para la ‘tripledemia’
- IA elimina las conjeturas de las pruebas de flujo lateral
- Prueba de antígeno del SARS-CoV-2 más rápida, jamás diseñada, permite realizar pruebas de COVID-19 no invasivas en cualquier entorno
- Pruebas rápidas de antígeno detectan las variantes ómicron, delta del SARS-CoV-2
- Prueba en sangre realizada durante la infección inicial predice el riesgo de COVID prolongada
- Investigadores afirman que hay que crear “reservistas” de laboratorio para responder más rápidamente a la próxima pandemia
- Estudio encuentra que los profesionales sanitarios mostraron mayor interés en tecnologías POC durante la pandemia
- Plataforma de análisis de bajo costo para la COVID-19 combina sensibilidad de la PCR y velocidad de pruebas de antígeno
- Prueba de sangre por punción digital identifica inmunidad a la COVID-19
- Kit de prueba rápida determina inmunidad contra la COVID-19 y sus variantes
Canales
Química Clínica
ver canal
Herramienta química a nanoescala 'brillantemente luminosa' mejora detección de enfermedades
Miles de moléculas brillantes disponibles comercialmente, conocidas como fluoróforos, se utilizan comúnmente en imágenes médicas, detección de enfermedades, marcado... Más
Prueba de detección portátil económica transforma detección de enfermedades renales
Millones de personas padecen enfermedad renal, que a menudo permanece sin diagnosticar hasta que alcanza una etapa crítica. Esta epidemia silenciosa no solo disminuye la calidad de vida de los afectados,... MásDiagnóstico Molecular
ver canal
Prueba de biomarcadores sanguíneos podría detectar predisposición genética al Alzheimer
Nuevos medicamentos para la enfermedad de Alzheimer, la forma más común de demencia, están ahora disponibles. Estos tratamientos, conocidos como "anticuerpos amiloides",... Más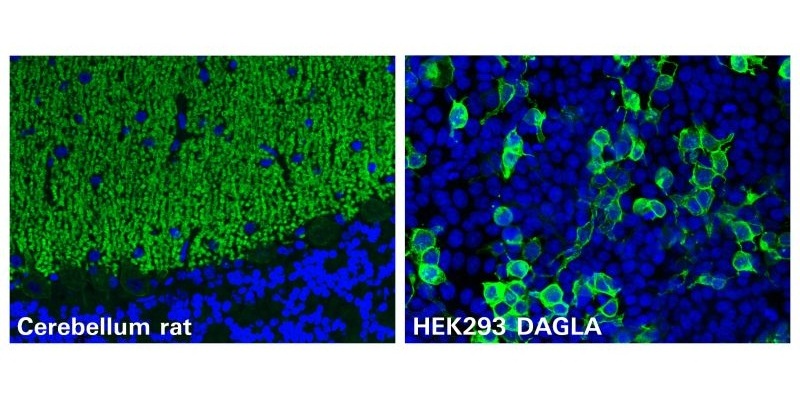
Se descubre nuevo autoanticuerpo contra DAGLA en cerebelitis
Las ataxias cerebelosas autoinmunes son trastornos muy incapacitantes que se caracterizan por una disminución de la habilidad para coordinar el movimiento muscular. Los autoanticuerpos cerebelosos... MásHematología
ver canal
Nuevo sistema de puntuación predice riesgo de cáncer a partir de un trastorno sanguíneo común
La citopenia clonal de significado incierto (CCSI) es un trastorno sanguíneo común en adultos mayores, caracterizado por mutaciones en las células sanguíneas y un recuento ... Más
Prueba prenatal no invasiva para determinar estado RhD del feto es 100 % precisa
En los Estados Unidos, aproximadamente el 15 % de las embarazadas son RhD negativas. Sin embargo, en aproximadamente el 40 % de estos casos, el feto también es RhD negativo, lo que hace innecesaria la... MásInmunología
ver canal
Prueba de células madre predice resultado del tratamiento en cáncer de ovario resistente al platino
El cáncer de ovario epitelial suele responder inicialmente a la quimioterapia, pero con el tiempo, el tumor desarrolla resistencia a la terapia, lo que provoca su recrecimiento. Esta resistencia... Más
Análisis de sangre con aprendizaje automático predice respuesta a inmunoterapia en pacientes con linfoma
La terapia de células T con receptores de antígenos quiméricos (CAR) se ha convertido en uno de los avances recientes más prometedores en el tratamiento de los cánceres... MásMicrobiología
ver canal
Dispositivo portátil ofrece resultados de tuberculosis económico y rápido
La tuberculosis (TB) sigue siendo la enfermedad infecciosa más mortal a nivel mundial, afectando a aproximadamente 10 millones de personas al año. En 2021, alrededor de 4,2 millones de casos... Más
Método basado en IA mejora diagnóstico de infecciones resistentes a fármacos
Las infecciones resistentes a los medicamentos, en particular las causadas por bacterias mortales como la tuberculosis y el estafilococo, se están convirtiendo rápidamente en una emergencia... MásPatología
ver canal
Nuevo método basado en aprendizaje automático detecta contaminación microbiana en cultivos celulares
La terapia celular tiene un gran potencial en el tratamiento de enfermedades como el cáncer, las enfermedades inflamatorias y los trastornos degenerativos crónicos mediante la manipulación o el reemplazo... Más
Nuevo método con corrección de errores detecta cáncer únicamente en muestras de sangre
La tecnología de biopsia líquida, que se basa en análisis de sangre para la detección temprana del cáncer y el seguimiento de la carga oncológica en los pacientes,... MásTecnología
ver canal
Tecnología de microchip desechable podría detectar selectivamente VIH en muestras de sangre completa
A finales de 2023, aproximadamente 40 millones de personas en todo el mundo vivían con VIH, y alrededor de 630.000 personas murieron por enfermedades relacionadas con el sida ese mismo año.... Más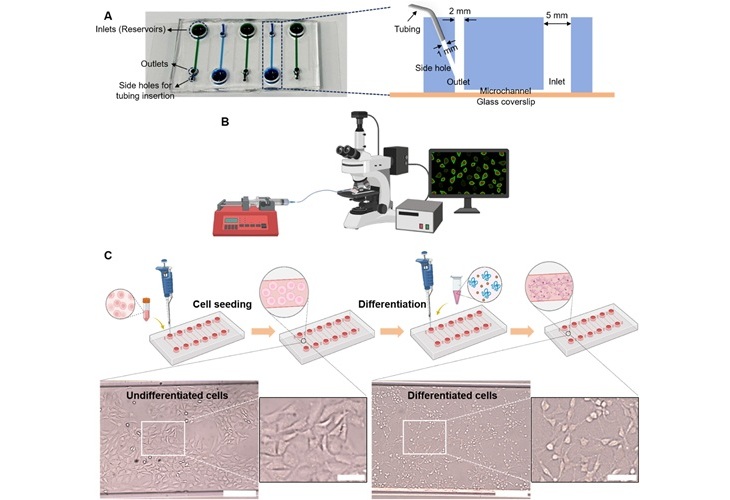
Dispositivo microfluídico Dolor en un Chip determina tipos de dolor crónico desde muestras de sangre
El dolor crónico es una afección generalizada que sigue siendo difícil de controlar, y los métodos clínicos existentes para su tratamiento se basan en gran medida en... MásIndustria
ver canal
Cepheid y Oxford Nanopore se unen para desarrollar soluciones con secuenciación automatizada
Cepheid (Sunnyvale, CA, EUA), una empresa líder en diagnóstico molecular, y Oxford Nanopore Technologies (Oxford, Reino Unido), la empresa detrás de una nueva generación de... Más