ACLA se opone a la decisión de la FDA de no continuar revisando las solicitudes de AUE para las pruebas desarrolladas en laboratorio para la COVID-19
|
Por el equipo editorial de LabMedica en español Actualizado el 12 Oct 2020 |

Ilustración
La Administración de Alimentos y Medicamentos de EUA (FDA Silver Spring, MD, EUA) ya no revisará las solicitudes de autorización de uso de emergencia (AUE) para las pruebas desarrolladas en el laboratorio (LDT) para la COVID-19.
La decisión de la FDA sigue a un anuncio en agosto del Departamento de Salud y Servicios Humanos de EUA de que no se requeriría que las LDT tuvieran que pasar por una revisión previa a la comercialización. La FDA actualizó sus Preguntas Frecuentes sobre el desarrollo y el desempeño de los diagnósticos para el SARS-CoV-2, que incluye el plan de la agencia para negarse a revisar las solicitudes de AUE para LDT. Sin embargo, la FDA continuará priorizando la revisión de las solicitudes de AUE para pruebas en los sitios de atención, las pruebas de recolección en el hogar, las pruebas caseras y cualquier prueba que reduzca la dependencia de los suministros de prueba, así como pruebas de alto rendimiento y ampliamente distribuidas. Con este cambio, la FDA tiene como objetivo aumentar la accesibilidad y la capacidad de las pruebas, según las Preguntas Frecuentes actualizadas de la agencia.
“Actualmente estamos en una fase diferente de la pandemia, con respecto a las pruebas, que antes, donde muchas pruebas de COVID-19 ahora están autorizadas para procesamiento en laboratorios”, escribió la FDA. “Damos prioridad a la revisión de las solicitudes de pruebas de la AUE teniendo en cuenta una variedad de factores, incluidos los discutidos en la Autorización de Uso en Emergencias de productos médicos y la Guía de Autoridades Relacionadas, como la necesidad de salud pública del producto y la disponibilidad Autorización de Uso en Emergencias”.
Sin embargo, la Asociación Estadounidense de Laboratorios Clínicos (ACLA Washington, DC, EUA) se opuso a la decisión de la FDA de dejar de revisar las AUE para las pruebas de COVID-19 desarrolladas en laboratorio. Una declaración emitida por la presidente de la ACLA, Julie Khani, dijo: “Muchas de las pruebas a las que se les han otorgado AUE para las pruebas de COVID-19 son LDT innovadoras de alto rendimiento que han reducido la dependencia de los suministros y han sido parte integral para expandir la capacidad de análisis. Estos son exactamente los tipos de pruebas que la FDA ha declarado que quiere priorizar. ACLA cree que la FDA debería seguir permitiendo que los laboratorios presenten voluntariamente la solicitud para una AUE para su revisión y autorización. El anuncio de hoy de la FDA crea una confusión innecesaria”.
Enlace relacionado:
Administración de Alimentos y Medicamentos de EUA (FDA)
Asociación Estadounidense de Laboratorios Clínicos (ACLA)
La decisión de la FDA sigue a un anuncio en agosto del Departamento de Salud y Servicios Humanos de EUA de que no se requeriría que las LDT tuvieran que pasar por una revisión previa a la comercialización. La FDA actualizó sus Preguntas Frecuentes sobre el desarrollo y el desempeño de los diagnósticos para el SARS-CoV-2, que incluye el plan de la agencia para negarse a revisar las solicitudes de AUE para LDT. Sin embargo, la FDA continuará priorizando la revisión de las solicitudes de AUE para pruebas en los sitios de atención, las pruebas de recolección en el hogar, las pruebas caseras y cualquier prueba que reduzca la dependencia de los suministros de prueba, así como pruebas de alto rendimiento y ampliamente distribuidas. Con este cambio, la FDA tiene como objetivo aumentar la accesibilidad y la capacidad de las pruebas, según las Preguntas Frecuentes actualizadas de la agencia.
“Actualmente estamos en una fase diferente de la pandemia, con respecto a las pruebas, que antes, donde muchas pruebas de COVID-19 ahora están autorizadas para procesamiento en laboratorios”, escribió la FDA. “Damos prioridad a la revisión de las solicitudes de pruebas de la AUE teniendo en cuenta una variedad de factores, incluidos los discutidos en la Autorización de Uso en Emergencias de productos médicos y la Guía de Autoridades Relacionadas, como la necesidad de salud pública del producto y la disponibilidad Autorización de Uso en Emergencias”.
Sin embargo, la Asociación Estadounidense de Laboratorios Clínicos (ACLA Washington, DC, EUA) se opuso a la decisión de la FDA de dejar de revisar las AUE para las pruebas de COVID-19 desarrolladas en laboratorio. Una declaración emitida por la presidente de la ACLA, Julie Khani, dijo: “Muchas de las pruebas a las que se les han otorgado AUE para las pruebas de COVID-19 son LDT innovadoras de alto rendimiento que han reducido la dependencia de los suministros y han sido parte integral para expandir la capacidad de análisis. Estos son exactamente los tipos de pruebas que la FDA ha declarado que quiere priorizar. ACLA cree que la FDA debería seguir permitiendo que los laboratorios presenten voluntariamente la solicitud para una AUE para su revisión y autorización. El anuncio de hoy de la FDA crea una confusión innecesaria”.
Enlace relacionado:
Administración de Alimentos y Medicamentos de EUA (FDA)
Asociación Estadounidense de Laboratorios Clínicos (ACLA)
Últimas COVID-19 noticias
- Inmunosensor nuevo allana el camino para pruebas rápidas POC para COVID-19 y enfermedades infecciosas emergentes
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Prueba nueva COVID + Influenza + VSR ayudará a estar preparados para la ‘tripledemia’
- IA elimina las conjeturas de las pruebas de flujo lateral
- Prueba de antígeno del SARS-CoV-2 más rápida, jamás diseñada, permite realizar pruebas de COVID-19 no invasivas en cualquier entorno
- Pruebas rápidas de antígeno detectan las variantes ómicron, delta del SARS-CoV-2
- Prueba en sangre realizada durante la infección inicial predice el riesgo de COVID prolongada
- Investigadores afirman que hay que crear “reservistas” de laboratorio para responder más rápidamente a la próxima pandemia
- Estudio encuentra que los profesionales sanitarios mostraron mayor interés en tecnologías POC durante la pandemia
- Plataforma de análisis de bajo costo para la COVID-19 combina sensibilidad de la PCR y velocidad de pruebas de antígeno
- Prueba de sangre por punción digital identifica inmunidad a la COVID-19
- Kit de prueba rápida determina inmunidad contra la COVID-19 y sus variantes
Canales
Química Clínica
ver canal
Espectrómetro de masas impreso en 3D para el punto de atención supera a los modelos de última generación
La espectrometría de masas es una técnica precisa para identificar los componentes químicos de una muestra y tiene un potencial significativo para monitorear estados de salud de enfermedades... Más.jpg)
Prueba biomédica POC hace girar una gota de agua utilizando ondas sonoras para detección del cáncer
Los exosomas, pequeñas biopartículas celulares que transportan un conjunto específico de proteínas, lípidos y materiales genéticos, desempeñan un papel... Más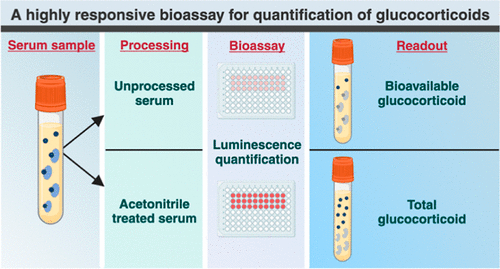
Prueba basada en células altamente confiable permite diagnóstico preciso de enfermedades endocrinas
Los métodos convencionales para medir el cortisol libre, la hormona del estrés del cuerpo, en la sangre o la saliva son bastante exigentes y requieren el procesamiento de muestras. Por lo tanto, el método... MásDiagnóstico Molecular
ver canal
Prueba de sangre predice con precisión el riesgo de cáncer de pulmón y reduce la necesidad de escaneos de TC
El cáncer de pulmón es extremadamente difícil de detectar tempranamente debido a las limitaciones de las tecnologías de detección actuales, que son costosas, a veces... Más
Firma única de autoanticuerpos ayuda a diagnosticar la esclerosis múltiple años antes de la aparición de síntomas
Se cree que las enfermedades autoinmunes como la esclerosis múltiple (EM) ocurren en parte debido a respuestas inmunes inusuales a infecciones comunes. Los primeros síntomas de la EM, incluidos... Más
Prueba de sangre podría detectar cánceres asociados al VPH 10 años antes del diagnóstico clínico
Se sabe que el virus del papiloma humano (VPH) causa varios cánceres, incluidos los de genitales, ano, boca, garganta y cuello uterino. El cáncer orofaríngeo asociado al VPH (VPH+COF)... Más
Un diagnóstico de bajo costo en el punto de atención ampliará el acceso a pruebas de enfermedades de transmisión sexual
La gonorrea es la segunda infección bacteriana de transmisión sexual (ITS) más comúnmente reportada, con alrededor de 82 millones de casos en todo el mundo en 2020. La infección puede tener graves consecuencias... MásHematología
ver canal
Primera prueba NAT 4 en 1 para el cribado de arbovirus podría reducir el riesgo de infecciones transmitidas por transfusiones
Los arbovirus representan una amenaza emergente para la salud mundial, exacerbada por el cambio climático y el aumento de la conectividad mundial que está facilitando su propagación a nuevas regiones.... Más
Instrumento de próxima generación detecta trastornos de la hemoglobina en recién nacidos
Las hemoglobinopatías, las enfermedades hereditarias más extendidas a nivel mundial, afectan a alrededor del 7 % de la población como portadores, y el 2,7 % de los recién nacidos nacen con estas enfermedades.... Más
Prueba de sangre POC por punción digital determina riesgo de sepsis neutropénica en pacientes sometidos a quimioterapia
La neutropenia, una disminución de los neutrófilos (un tipo de glóbulo blanco crucial para combatir las infecciones), es un efecto secundario frecuente de ciertos tratamientos contra... Más
Primera prueba rápida y asequible para beta talasemia demuestra precisión diagnóstica del 99 %
Los trastornos de la hemoglobina se encuentran entre las enfermedades monogénicas más prevalentes a nivel mundial. Entre los diversos trastornos de la hemoglobina, la beta talasemia, un trastorno sanguíneo... MásInmunología
ver canal
Análisis de sangre para diagnóstico de rechazo celular después de trasplante de órganos podría reemplazar las biopsias quirúrgicas
Los órganos trasplantados enfrentan constantemente el riesgo de ser rechazados por el sistema inmunológico del receptor, que los diferencia de los órganos no propios mediante... Más
Herramienta de IA ajusta con precisión los medicamentos contra el cáncer con los pacientes utilizando información de cada célula tumoral
Las estrategias actuales para emparejar a los pacientes con cáncer con tratamientos específicos a menudo dependen de la secuenciación masiva de ADN y ARN tumoral, que proporciona un perfil promedio de... Más
Pruebas genéticas combinadas con la detección de fármacos personalizadas en muestras de tumores podrían revolucionar el tratamiento del cáncer
El tratamiento del cáncer generalmente se adhiere a un estándar de atención: regímenes establecidos y validados estadísticamente que son efectivos para la mayoría de los pacientes. Sin embargo, la variabilidad... Más
Método de prueba podría ayudar a más pacientes recibir tratamiento adecuado contra el cáncer
El tratamiento del cáncer no siempre es una solución única, pero el campo de la investigación del cáncer está dando grandes pasos para encontrar a los pacientes los tratamientos más eficaces para sus afecciones... MásMicrobiología
ver canal
Nuevos ensayos de hepatitis con marcado CE permite la detección temprana de infecciones
Según la Organización Mundial de la Salud (OMS), se estima que 354 millones de personas en todo el mundo padecen hepatitis B o C crónica. Estos virus son las principales causas de... Más
Prueba de PCR múltiplex identifica el 95 % de los patógenos que causan la sepsis en una hora
La sepsis contribuye a una de cada tres muertes hospitalarias en los Estados Unidos y, a nivel mundial, el shock séptico conlleva una tasa de mortalidad del 30 al 40 %. El diagnóstico temprano de la sepsis... Más
Prueba de bacterias bucales podría predecir la progresión del cáncer de colon
El cáncer de colon, una enfermedad relativamente común pero difícil de diagnosticar, requiere confirmación mediante una colonoscopia o cirugía. Recientemente, ha habido... Más.jpg)
Firma metabólica unica podría permitir el diagnóstico de sepsis dentro de una hora de la extracción de sangre
La sepsis es una afección potencialmente mortal provocada por una respuesta extrema del cuerpo a una infección. Requiere intervención médica inmediata para evitar una posible muerte o daños duraderos.... MásPatología
ver canalSistema de imágenes digitales impulsado por IA podría revolucionar el diagnóstico del cáncer
El proceso de biopsia es importante para confirmar la presencia de cáncer. En la técnica de histopatología convencional, el tejido se extirpa, se corta, se tiñe, se monta en... Más
Nuevo panel de mycobacterium tuberculosis respalda la vigilancia en tiempo real y combate la resistencia a los antimicrobianos
La tuberculosis (TB), la principal causa de muerte por enfermedad infecciosa a nivel mundial, es una infección bacteriana contagiosa que se propaga principalmente a través de la tos de pacientes con tuberculosis... Más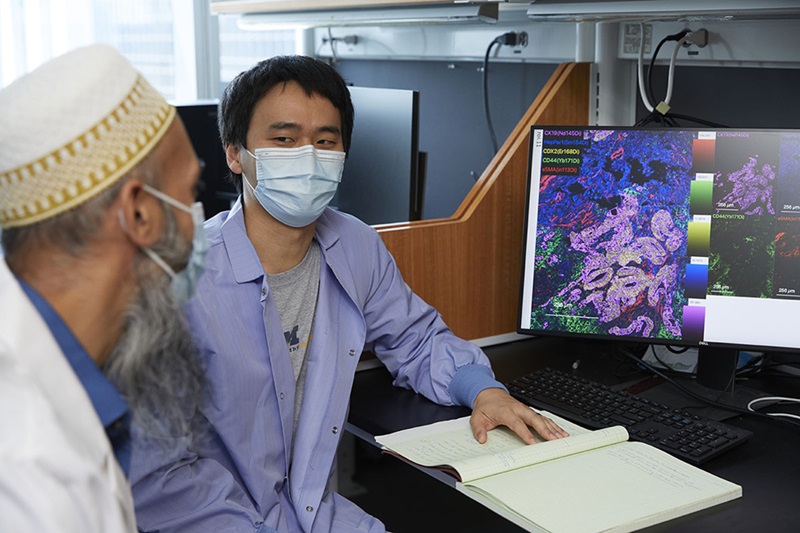
Análisis de tejido espacial identifica patrones asociados con la recaída del cáncer de ovario
El carcinoma de ovario seroso de alto grado es el tipo más letal de cáncer de ovario y plantea importantes desafíos de detección. Por lo general, los pacientes responden inicialmente... Más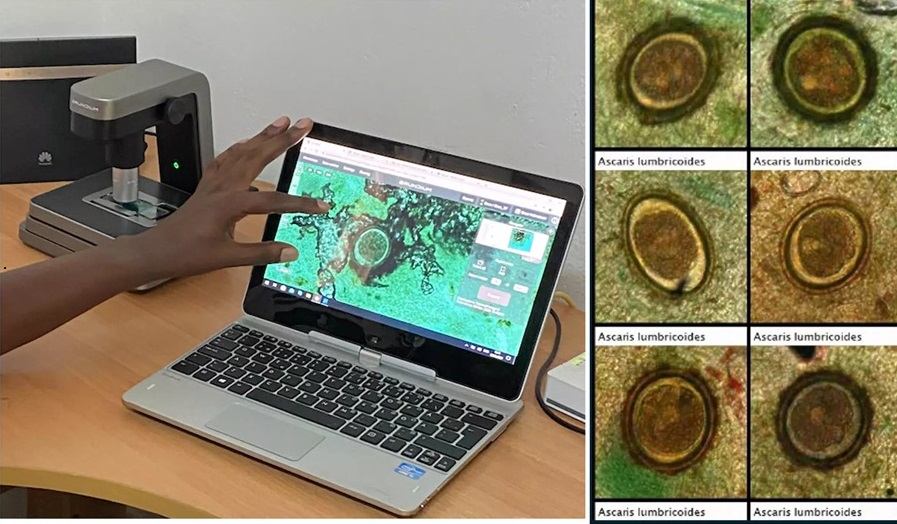
IA basada en imágenes se muestra prometedora para detección de parásitos en muestras de heces digitalizadas
Las infecciones por helmintos transmitidos por el suelo (STH), comúnmente conocidas como gusanos parásitos intestinales, se encuentran entre las enfermedades tropicales desatendidas más... MásTecnología
ver canal
Nuevo sistema de diagnóstico de laboratorio en un chip iguala la precisión de las pruebas de PCR
Si bien las pruebas de PCR son el estándar de oro en cuanto a precisión para las pruebas de virología, tienen limitaciones como la complejidad, la necesidad de operadores de laboratorio capacitados y tiempos... Más
Biosensor de ADN permite diagnóstico temprano del cáncer de cuello uterino
El disulfuro de molibdeno (MoS2), reconocido por su potencial para formar nanoláminas bidimensionales como el grafeno, es un material que llama cada vez más la atención de la comunidad... Más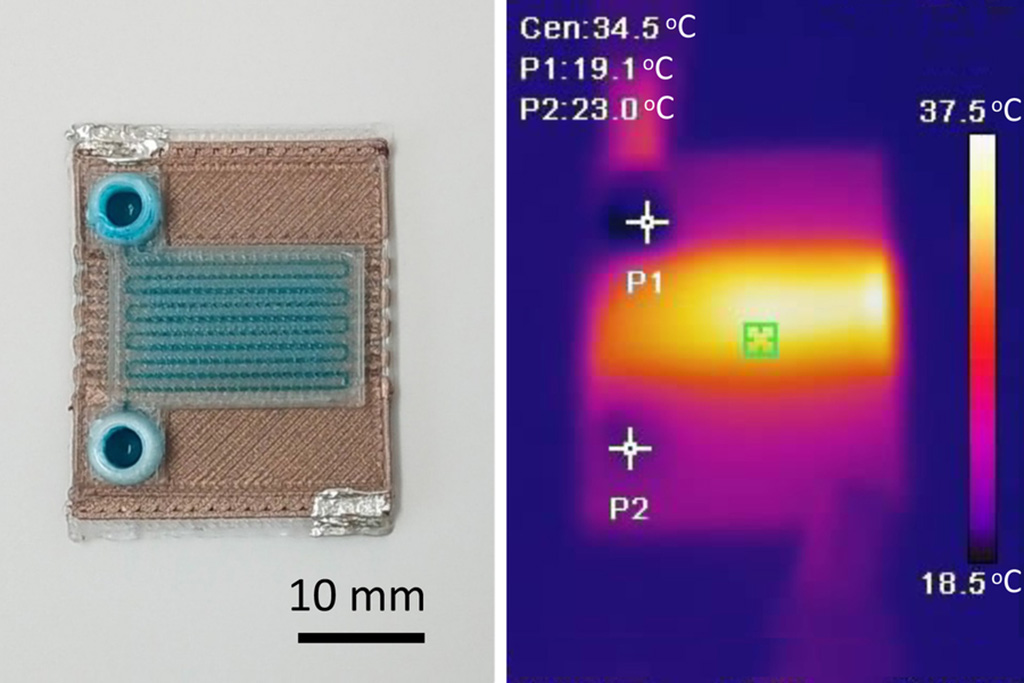
Dispositivos de microfluidos autocalentables pueden detectar enfermedades en pequeñas muestras de sangre o fluidos
Los microfluidos, que son dispositivos en miniatura que controlan el flujo de líquidos y facilitan reacciones químicas, desempeñan un papel clave en la detección de enfermedades... Más
Avance en tecnología de diagnóstico podría hacer que pruebas en el sitio sean ampliamente accesibles
Las pruebas caseras adquirieron una importancia significativa durante la pandemia de COVID-19, sin embargo, la disponibilidad de pruebas rápidas es limitada y la mayoría de ellas solo pueden conducir un... MásIndustria
ver canal
Congreso ECCMID cambia de nombre a ESCMID Global
En los últimos años, la Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas (ESCMID, Basilea, Suiza) ha evolucionado notablemente. La sociedad es ahora más... Más














