Validan clínicamente prueba de ADN tumoral circulante
|
Por el equipo editorial de LabMedica en español Actualizado el 30 May 2022 |
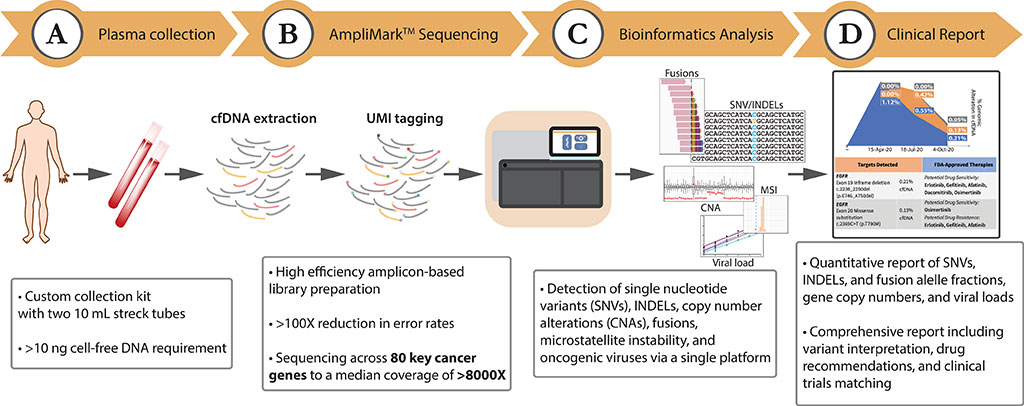
La secuenciación de próxima generación del ADN tumoral circulante presenta un enfoque prometedor para el diagnóstico del cáncer, que complementa las pruebas de diagnóstico convencionales basadas en tejidos al permitir pruebas en serie mínimamente invasivas y una amplia cobertura genómica a través de una simple extracción de sangre para maximizar el beneficio terapéutico para los pacientes.
El diagnóstico y la subclasificación de los cánceres, fundamentales en cualquier algoritmo de tratamiento del cáncer, se ha logrado históricamente a través del estudio del tejido tumoral primario. La disponibilidad de material de diagnóstico de alta calidad adecuado para tecnologías genómicas de alto nivel, incluida la genotipificación basada en tejidos multiplexados, a menudo es limitante y está asociada con altos riesgos y costos.
Los científicos de Lucence Diagnostics Pte Ltd (Singapur, Singapur) recolectaron 1.592 muestras clínicas consecutivas incluidas en los análisis observacionales que se recibieron como muestras clínicas de rutina y que se sometieron a un procesamiento e informe estándar en un laboratorio acreditado por CAP y CLIA. Se recolectaron tubos de sangre total para cada paciente con el Streck Cell-Free DNA BCT (Streck, La Vista, NE, EUA), se enviaron a Lucence Diagnostics a temperatura ambiente y se procesaron dentro de las 6 a 48 horas posteriores a la recolección de la muestra.
El equipo utilizó la prueba LiquidHALLMARK de Lucence Diagnostics, que es un ensayo de secuenciación de próxima generación, basado en amplicones, desarrollado para el perfil genómico del ADN libre de células derivado de plasma (ADNlc). El panel integral de 80 genes perfila mutaciones puntuales, inserciones/eliminaciones, alteraciones del número de copias y fusiones de genes, y además detecta virus oncogénicos (virus de Epstein-Barr (VEB) y virus de la hepatitis B (VHB)) e inestabilidad de microsatélites (MSI).
Los investigadores informaron que la validación analítica utilizando materiales genéticos de referencia demostró una sensibilidad del 99,4 % para mutaciones puntuales y del 95,8 % para inserciones/deleciones al 0,1 % de frecuencia alélica variante (VAF), y una sensibilidad del 91,7 % para fusiones de genes al 0,5 % de VAF. En muestras no cancerosas, se observó una alta especificidad (≥99,9999 % por base).
También se determinó empíricamente el límite de detección para alteraciones del número de copias, VEB, VHB y la MSI. La comparación ortogonal de células variantes del receptor del factor de crecimiento epidérmico (EGFR) realizadas por LiquidHALLMARK y un método de reacción en cadena de la polimerasa específico de alelo (AS-PCR) de referencia para 355 muestras de cáncer de pulmón reveló una concordancia general del 93,8 %, mientras que la validación externa con cobas la Prueba de Mutación del EGFR vobas v2 (Roche, Basilea, Suiza) para 50 muestras de cáncer de pulmón demostró una concordancia general del 84,0 %, con una tasa de concordancia del 100 % para las variantes de EGFR por encima del 0,4 % de VAF.
La aplicación clínica de LiquidHALLMARK en 1.592 pacientes consecutivos demostró una alta tasa de detección (74,8 % de ADN tumoral circulante (ADNtc) positivo en muestras de cáncer) y una amplia capacidad de acción (50,0 % de las muestras de cáncer que albergan alteraciones con evidencia biológica de capacidad de acción). Entre los cánceres de pulmón positivos para ADNtc, el 72,5 % albergaba al menos un biomarcador con una indicación de fármaco aprobada por las guías.
Los autores concluyeron que sus resultados establecieron la alta sensibilidad, especificidad, exactitud y precisión del ensayo LiquidHALLMARK y respaldan su aplicación clínica para pruebas genómicas en sangre. El estudio fue publicado el 29 de abril de 2022 en la revista PLOS ONE .
Enlaces relacionados:
Lucence Diagnostics Pte Ltd
Streck
Roche
Últimas Diagnóstico Molecular noticias
- Prueba de calprotectina predice riesgo de enfermedad cardíaca aterosclerótica
- Prueba de sangre económica permite detección temprana del Alzheimer
- Plataforma de diagnóstico POC combina inmunoensayo y pruebas moleculares
- Prueba innovadora evalúa con precisión gravedad de fibrosis hepática en solo 18 minutos
- Único análisis de sangre podría detectar distintos tipos de cáncer en etapas tempranas
- Prueba de hisopado oral POC para aumenta posibilidades de embarazo en la FIV
- Prueba de ADN microbiano libre de células identifica patógenos de neumonía y otras infecciones pulmonares
- Método sin biopsia transforma diagnóstico de enfermedad celíaca en adultos
- Innovadora prueba de diagnóstico molecular señala con precisión principal causa genética de EPOC
- Prueba diagnóstica de sangre detecta espondiloartritis axial
- Nueva etiqueta molecular desarrolla pruebas de tuberculosis más sencillas y rápidas
- Descubrimiento de biomarcador abre camino para que análisis de sangre detecten y traten osteoartritis
- Prueba de biopsia líquida detecta recurrencia en pacientes con CCR antes de las imágenes
- Prueba ultrarrápida de líquido sinovial diagnostica osteoartritis y artritis reumatoide en 10 minutos
- Herramienta genética predice supervivencia de pacientes con cáncer de páncreas
- Prueba de orina diagnostica cáncer de próstata inicial
Canales
Química Clínica
ver canal
Análisis de sangre con IA detecta cáncer de ovario
El cáncer de ovario se ubica como la quinta causa principal de muerte por cáncer en mujeres, debido principalmente a diagnósticos en etapas tardías. Si bien más del 90... Más
Ensayo automatizado y descentralizado de NGS de ADNlc identifica alteraciones en tumores sólidos avanzados
Los análisis actuales de ADN libre circulante (ADNlc) suelen estar centralizados, lo que requiere un manejo y transporte especializados de las muestras. La introducción de un sistema de secuenciación flexible... MásHematología
ver canal
Primera prueba de monitorización de heparina POC proporciona resultados rápidos
La dosificación de heparina requiere un manejo cuidadoso para evitar complicaciones hemorrágicas y de coagulación. En situaciones de alto riesgo, como la oxigenación por membrana... Más
Nuevo sistema de puntuación predice riesgo de cáncer a partir de un trastorno sanguíneo común
La citopenia clonal de significado incierto (CCSI) es un trastorno sanguíneo común en adultos mayores, caracterizado por mutaciones en las células sanguíneas y un recuento ... MásInmunología
ver canal
Prueba de células madre predice resultado del tratamiento en cáncer de ovario resistente al platino
El cáncer de ovario epitelial suele responder inicialmente a la quimioterapia, pero con el tiempo, el tumor desarrolla resistencia a la terapia, lo que provoca su recrecimiento. Esta resistencia... Más
Análisis de sangre con aprendizaje automático predice respuesta a inmunoterapia en pacientes con linfoma
La terapia de células T con receptores de antígenos quiméricos (CAR) se ha convertido en uno de los avances recientes más prometedores en el tratamiento de los cánceres... MásMicrobiología
ver canal
Nuevo análisis de sangre detecta hasta cinco enfermedades infecciosas en punto de atención
Los investigadores han desarrollado un prototipo de ensayo de flujo continuo capaz de detectar hasta cinco infecciones diferentes, cuyos resultados pueden analizarse y transmitirse rápidamente mediante... Más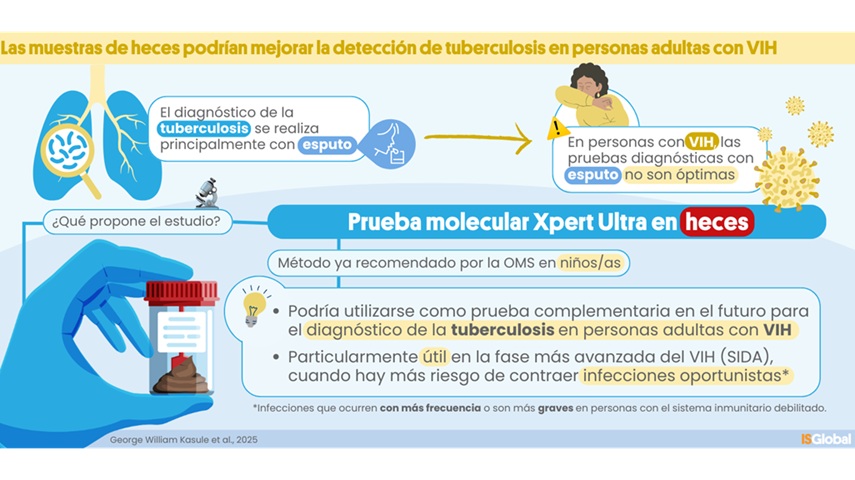
Prueba molecular de heces muestra potencial para diagnosticar tuberculosis en adultos con VIH
La tuberculosis (TB), causada por la bacteria Mycobacterium tuberculosis, provocó 1,25 millones de muertes en 2023, de las cuales el 13 % se produjeron en personas con VIH. El principal método... MásPatología
ver canal
Microscopio con IA detecta coágulos de sangre mortales antes de reproducirse
Las plaquetas son pequeñas células sanguíneas que actúan como agentes de emergencia en el cuerpo, acudiendo rápidamente a las zonas lesionadas para ayudar a detener el... Más
Combinación de técnicas de laboratorio proporciona conocimientos más profundos sobre tumores cerebrales mortales
El glioblastoma (GBM) es un cáncer cerebral primario altamente agresivo que actualmente cuenta con tratamientos efectivos limitados. Las biopsias estereotácticas con aguja se emplean comúnmente para el... MásTecnología
ver canal
Algoritmos predictivos avanzados identifican pacientes con cáncer no diagnosticado
Dos algoritmos predictivos avanzados recientemente desarrollados aprovechan el estado de salud de una persona y los resultados de análisis de sangre básicos para predecir con precisión... Más
Algoritmo de firma de luz permite diagnósticos médicos más rápidos y precisos
Cada material o molécula interactúa con la luz de forma única, creando un patrón distintivo, similar a una huella dactilar. La espectroscopia óptica, que consiste en... MásIndustria
ver canal
Qiagen adquiere Genoox, empresa de software de análisis NGS
QIAGEN (Venlo, Países Bajos) ha firmado un acuerdo definitivo para adquirir Genoox (Tel Aviv, Israel), un proveedor de software impulsado por inteligencia artificial (IA) que permite a los laboratorios... Más