Comirnaty de Pfizer-BioNTech se convierte en la primera vacuna contra la COVID-19 en recibir la aprobación total de la FDA de los Estados Unidos
|
Por el equipo editorial de LabMedica en español Actualizado el 30 Aug 2021 |
Image
La Administración de Alimentos y Medicamentos de EUA aprobó la Solicitud de Licencia de Productos Biológicos (BLA) para COMIRNATY (vacuna COVID-19, ARNm) desarrollada conjuntamente por Pfizer Inc. (Nueva York, NY, EUA) y Biopharmaceutical New Technologies (BioNTech Maguncia, Alemania) para prevenir la COVID-19 en personas mayores de 16 años, lo que la convierte en la primera vacuna COVID-19 en recibir la aprobación de la FDA.
COMIRNATY, que se basa en la tecnología de ARNm patentada de BioNTech, contiene ARN mensajero (ARNm), una especie de material genético. El cuerpo utiliza el ARNm para imitar una de las proteínas del virus que causa la COVID-19. El resultado de que una persona reciba esta vacuna es que su sistema inmunológico finalmente reaccionará de manera defensiva al virus que causa la COVID-19. El ARNm de Comirnaty solo está presente en el cuerpo durante un corto período de tiempo y no se incorpora al material genético de un individuo, ni lo altera.
La vacuna ha estado disponible en los EUA bajo una Autorización de Uso de Emergencia (AUE) desde el 11 de diciembre de 2020 (como la vacuna Pfizer-BioNTech COVID-19). La AUE permitió el despliegue esencial de dosis de vacunas en los EUA para ayudar a brindar protección durante la emergencia de salud pública COVID-19, según los datos iniciales del ensayo clínico fundamental de fase 3. Para la aprobación de la FDA, Pfizer y BioNTech presentaron un paquete de datos completo que incluía datos de seguimiento a más largo plazo del ensayo de fase 3, donde se observó la alta eficacia y el perfil de seguridad favorable de la vacuna hasta seis meses después de la segunda dosis. El paquete de presentación de BLA también incluía los datos de fabricación e instalaciones necesarios para obtener la licencia. Pfizer y BioNTech completaron la presentación de la BLA en mayo de 2021, y la BLA recibió una Revisión Prioritaria en julio de 2021.
“Sobre la base de los datos de seguimiento a más largo plazo que presentamos, la decisión de hoy de la FDA afirma el perfil de eficacia y seguridad de nuestra vacuna en un momento en que se necesita con urgencia. Aproximadamente el 60% de los estadounidenses elegibles están completamente vacunados, y las tasas de infección, hospitalización y muerte continúan aumentando rápidamente entre las poblaciones no vacunadas en todo el país”, dijo Albert Bourla, presidente y director ejecutivo de Pfizer. “Espero que esta aprobación ayude a aumentar la confianza en nuestra vacuna, ya que la vacunación sigue siendo la mejor herramienta que tenemos para ayudar a proteger vidas y lograr la inmunidad colectiva. Ya se han administrado cientos de millones de dosis de nuestra vacuna en los EUA desde diciembre de 2020, y esperamos continuar trabajando con el gobierno de EUA para llegar a más estadounidenses ahora que tenemos la aprobación de la FDA”.
“La aprobación total de hoy por parte de la FDA subraya la alta eficacia y el perfil de seguridad favorable de la vacuna”, dijo Ugur Sahin, M.D., director ejecutivo y cofundador de BioNTech. “Nuestras empresas han enviado más de mil millones de dosis en todo el mundo y continuaremos trabajando incansablemente para ampliar el acceso a nuestra vacuna y estar preparados para posibles variantes de escape emergentes”.
“Nuestros expertos médicos y científicos llevaron a cabo una evaluación increíblemente exhaustiva y reflexiva de esta vacuna. Evaluamos los datos científicos y la información incluida en cientos de miles de páginas, realizamos nuestros propios análisis de la seguridad y eficacia de Comirnaty y realizamos una evaluación detallada de los procesos de fabricación, incluidas las inspecciones de las instalaciones de fabricación”, dijo Peter Marks, MD, Ph.D., director del Centro de Evaluación e Investigación de Productos Biológicos de la FDA. “No hemos perdido de vista que la crisis de salud pública de COVID-19 continúa en los EUA y que el público quiere vacunas seguras y efectivas. El público y la comunidad médica pueden estar seguros de que, aunque aprobamos esta vacuna rápidamente, cumplió plenamente con nuestros altos estándares existentes para las vacunas en los EUA”.
Enlace relacionado:
Pfizer Inc.
Biopharmaceutical New Technologies
COMIRNATY, que se basa en la tecnología de ARNm patentada de BioNTech, contiene ARN mensajero (ARNm), una especie de material genético. El cuerpo utiliza el ARNm para imitar una de las proteínas del virus que causa la COVID-19. El resultado de que una persona reciba esta vacuna es que su sistema inmunológico finalmente reaccionará de manera defensiva al virus que causa la COVID-19. El ARNm de Comirnaty solo está presente en el cuerpo durante un corto período de tiempo y no se incorpora al material genético de un individuo, ni lo altera.
La vacuna ha estado disponible en los EUA bajo una Autorización de Uso de Emergencia (AUE) desde el 11 de diciembre de 2020 (como la vacuna Pfizer-BioNTech COVID-19). La AUE permitió el despliegue esencial de dosis de vacunas en los EUA para ayudar a brindar protección durante la emergencia de salud pública COVID-19, según los datos iniciales del ensayo clínico fundamental de fase 3. Para la aprobación de la FDA, Pfizer y BioNTech presentaron un paquete de datos completo que incluía datos de seguimiento a más largo plazo del ensayo de fase 3, donde se observó la alta eficacia y el perfil de seguridad favorable de la vacuna hasta seis meses después de la segunda dosis. El paquete de presentación de BLA también incluía los datos de fabricación e instalaciones necesarios para obtener la licencia. Pfizer y BioNTech completaron la presentación de la BLA en mayo de 2021, y la BLA recibió una Revisión Prioritaria en julio de 2021.
“Sobre la base de los datos de seguimiento a más largo plazo que presentamos, la decisión de hoy de la FDA afirma el perfil de eficacia y seguridad de nuestra vacuna en un momento en que se necesita con urgencia. Aproximadamente el 60% de los estadounidenses elegibles están completamente vacunados, y las tasas de infección, hospitalización y muerte continúan aumentando rápidamente entre las poblaciones no vacunadas en todo el país”, dijo Albert Bourla, presidente y director ejecutivo de Pfizer. “Espero que esta aprobación ayude a aumentar la confianza en nuestra vacuna, ya que la vacunación sigue siendo la mejor herramienta que tenemos para ayudar a proteger vidas y lograr la inmunidad colectiva. Ya se han administrado cientos de millones de dosis de nuestra vacuna en los EUA desde diciembre de 2020, y esperamos continuar trabajando con el gobierno de EUA para llegar a más estadounidenses ahora que tenemos la aprobación de la FDA”.
“La aprobación total de hoy por parte de la FDA subraya la alta eficacia y el perfil de seguridad favorable de la vacuna”, dijo Ugur Sahin, M.D., director ejecutivo y cofundador de BioNTech. “Nuestras empresas han enviado más de mil millones de dosis en todo el mundo y continuaremos trabajando incansablemente para ampliar el acceso a nuestra vacuna y estar preparados para posibles variantes de escape emergentes”.
“Nuestros expertos médicos y científicos llevaron a cabo una evaluación increíblemente exhaustiva y reflexiva de esta vacuna. Evaluamos los datos científicos y la información incluida en cientos de miles de páginas, realizamos nuestros propios análisis de la seguridad y eficacia de Comirnaty y realizamos una evaluación detallada de los procesos de fabricación, incluidas las inspecciones de las instalaciones de fabricación”, dijo Peter Marks, MD, Ph.D., director del Centro de Evaluación e Investigación de Productos Biológicos de la FDA. “No hemos perdido de vista que la crisis de salud pública de COVID-19 continúa en los EUA y que el público quiere vacunas seguras y efectivas. El público y la comunidad médica pueden estar seguros de que, aunque aprobamos esta vacuna rápidamente, cumplió plenamente con nuestros altos estándares existentes para las vacunas en los EUA”.
Enlace relacionado:
Pfizer Inc.
Biopharmaceutical New Technologies
Últimas COVID-19 noticias
- Inmunosensor nuevo allana el camino para pruebas rápidas POC para COVID-19 y enfermedades infecciosas emergentes
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Prueba nueva COVID + Influenza + VSR ayudará a estar preparados para la ‘tripledemia’
- IA elimina las conjeturas de las pruebas de flujo lateral
- Prueba de antígeno del SARS-CoV-2 más rápida, jamás diseñada, permite realizar pruebas de COVID-19 no invasivas en cualquier entorno
- Pruebas rápidas de antígeno detectan las variantes ómicron, delta del SARS-CoV-2
- Prueba en sangre realizada durante la infección inicial predice el riesgo de COVID prolongada
- Investigadores afirman que hay que crear “reservistas” de laboratorio para responder más rápidamente a la próxima pandemia
- Estudio encuentra que los profesionales sanitarios mostraron mayor interés en tecnologías POC durante la pandemia
- Plataforma de análisis de bajo costo para la COVID-19 combina sensibilidad de la PCR y velocidad de pruebas de antígeno
- Prueba de sangre por punción digital identifica inmunidad a la COVID-19
- Kit de prueba rápida determina inmunidad contra la COVID-19 y sus variantes
Canales
Química Clínica
ver canal
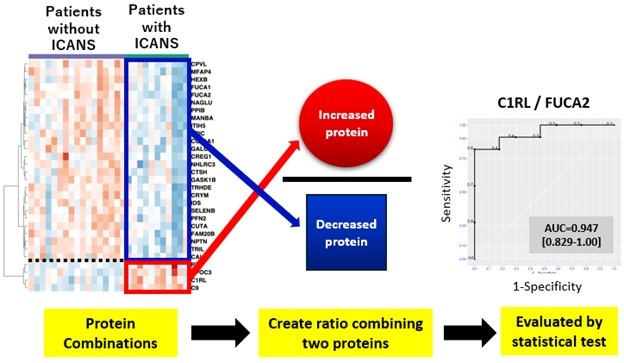
Monitorización con espectrometría de masas predice e identifica recaída temprana del mieloma
El mieloma, un tipo de cáncer que afecta la médula ósea, es actualmente incurable, aunque muchos pacientes pueden vivir más de 10 años tras el diagnóstico.... Más
Herramienta química a nanoescala 'brillantemente luminosa' mejora detección de enfermedades
Miles de moléculas brillantes disponibles comercialmente, conocidas como fluoróforos, se utilizan comúnmente en imágenes médicas, detección de enfermedades, marcado... MásDiagnóstico Molecular
ver canal
Herramienta genética predice supervivencia de pacientes con cáncer de páncreas
Un marcador tumoral es una sustancia presente en el organismo que puede indicar la presencia de cáncer. Estas sustancias, que pueden incluir proteínas, genes, moléculas u otros compuestos... Más
Prueba de orina diagnostica cáncer de próstata inicial
El cáncer de próstata es una de las principales causas de muerte en hombres a nivel mundial. Un desafío importante para diagnosticar la enfermedad es la ausencia de biomarcadores confiables... MásHematología
ver canal
Nuevo sistema de puntuación predice riesgo de cáncer a partir de un trastorno sanguíneo común
La citopenia clonal de significado incierto (CCSI) es un trastorno sanguíneo común en adultos mayores, caracterizado por mutaciones en las células sanguíneas y un recuento ... Más
Prueba prenatal no invasiva para determinar estado RhD del feto es 100 % precisa
En los Estados Unidos, aproximadamente el 15 % de las embarazadas son RhD negativas. Sin embargo, en aproximadamente el 40 % de estos casos, el feto también es RhD negativo, lo que hace innecesaria la... MásInmunología
ver canal
Prueba de células madre predice resultado del tratamiento en cáncer de ovario resistente al platino
El cáncer de ovario epitelial suele responder inicialmente a la quimioterapia, pero con el tiempo, el tumor desarrolla resistencia a la terapia, lo que provoca su recrecimiento. Esta resistencia... Más
Análisis de sangre con aprendizaje automático predice respuesta a inmunoterapia en pacientes con linfoma
La terapia de células T con receptores de antígenos quiméricos (CAR) se ha convertido en uno de los avances recientes más prometedores en el tratamiento de los cánceres... MásMicrobiología
ver canal
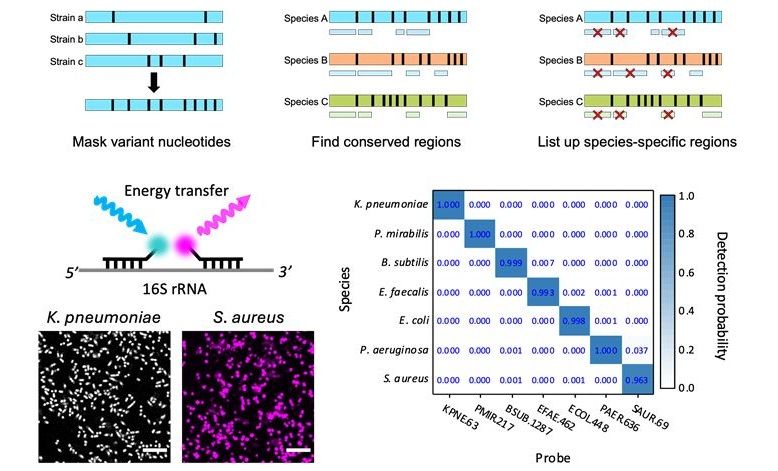
Nueva prueba diagnostica meningitis bacteriana con rapidez y precisión
La meningitis bacteriana es una afección potencialmente mortal: uno de cada seis pacientes fallece y la mitad de los supervivientes experimentan síntomas persistentes. Por lo tanto, un d... Más
Dispositivo portátil ofrece resultados de tuberculosis económico y rápido
La tuberculosis (TB) sigue siendo la enfermedad infecciosa más mortal a nivel mundial, afectando a aproximadamente 10 millones de personas al año. En 2021, alrededor de 4,2 millones de casos... MásPatología
ver canal
Modelo de IA predice respuesta a terapia contra cáncer de riñón
Cada año, cerca de 435.000 personas son diagnosticadas con carcinoma renal de células claras (CRcc), lo que lo convierte en el subtipo más prevalente de cáncer de riñón.... Más
Kits de ensayo de enzima DUB sensibles y específicos requieren configuración mínima sin preparación del sustrato
La ubiquitinación y la desubiquitinación son dos procesos fisiológicos importantes en el sistema ubiquitina-proteasoma, responsable de la degradación de proteínas en... MásTecnología
ver canal
Algoritmo de firma ligera permite diagnósticos médicos más rápidos y precisos
Cada material o molécula interactúa con la luz de forma única, creando un patrón distintivo, similar a una huella dactilar. La espectroscopia óptica, que consiste en... Más
Tecnología de microchip desechable podría detectar selectivamente VIH en muestras de sangre completa
A finales de 2023, aproximadamente 40 millones de personas en todo el mundo vivían con VIH, y alrededor de 630.000 personas murieron por enfermedades relacionadas con el sida ese mismo año.... MásIndustria
ver canal
Cepheid y Oxford Nanopore se unen para desarrollar soluciones con secuenciación automatizada
Cepheid (Sunnyvale, CA, EUA), una empresa líder en diagnóstico molecular, y Oxford Nanopore Technologies (Oxford, Reino Unido), la empresa detrás de una nueva generación de... Más