ACLA se opone a la decisión de la FDA de no continuar revisando las solicitudes de AUE para las pruebas desarrolladas en laboratorio para la COVID-19
|
Por el equipo editorial de LabMedica en español Actualizado el 12 Oct 2020 |

Ilustración
La Administración de Alimentos y Medicamentos de EUA (FDA Silver Spring, MD, EUA) ya no revisará las solicitudes de autorización de uso de emergencia (AUE) para las pruebas desarrolladas en el laboratorio (LDT) para la COVID-19.
La decisión de la FDA sigue a un anuncio en agosto del Departamento de Salud y Servicios Humanos de EUA de que no se requeriría que las LDT tuvieran que pasar por una revisión previa a la comercialización. La FDA actualizó sus Preguntas Frecuentes sobre el desarrollo y el desempeño de los diagnósticos para el SARS-CoV-2, que incluye el plan de la agencia para negarse a revisar las solicitudes de AUE para LDT. Sin embargo, la FDA continuará priorizando la revisión de las solicitudes de AUE para pruebas en los sitios de atención, las pruebas de recolección en el hogar, las pruebas caseras y cualquier prueba que reduzca la dependencia de los suministros de prueba, así como pruebas de alto rendimiento y ampliamente distribuidas. Con este cambio, la FDA tiene como objetivo aumentar la accesibilidad y la capacidad de las pruebas, según las Preguntas Frecuentes actualizadas de la agencia.
“Actualmente estamos en una fase diferente de la pandemia, con respecto a las pruebas, que antes, donde muchas pruebas de COVID-19 ahora están autorizadas para procesamiento en laboratorios”, escribió la FDA. “Damos prioridad a la revisión de las solicitudes de pruebas de la AUE teniendo en cuenta una variedad de factores, incluidos los discutidos en la Autorización de Uso en Emergencias de productos médicos y la Guía de Autoridades Relacionadas, como la necesidad de salud pública del producto y la disponibilidad Autorización de Uso en Emergencias”.
Sin embargo, la Asociación Estadounidense de Laboratorios Clínicos (ACLA Washington, DC, EUA) se opuso a la decisión de la FDA de dejar de revisar las AUE para las pruebas de COVID-19 desarrolladas en laboratorio. Una declaración emitida por la presidente de la ACLA, Julie Khani, dijo: “Muchas de las pruebas a las que se les han otorgado AUE para las pruebas de COVID-19 son LDT innovadoras de alto rendimiento que han reducido la dependencia de los suministros y han sido parte integral para expandir la capacidad de análisis. Estos son exactamente los tipos de pruebas que la FDA ha declarado que quiere priorizar. ACLA cree que la FDA debería seguir permitiendo que los laboratorios presenten voluntariamente la solicitud para una AUE para su revisión y autorización. El anuncio de hoy de la FDA crea una confusión innecesaria”.
Enlace relacionado:
Administración de Alimentos y Medicamentos de EUA (FDA)
Asociación Estadounidense de Laboratorios Clínicos (ACLA)
La decisión de la FDA sigue a un anuncio en agosto del Departamento de Salud y Servicios Humanos de EUA de que no se requeriría que las LDT tuvieran que pasar por una revisión previa a la comercialización. La FDA actualizó sus Preguntas Frecuentes sobre el desarrollo y el desempeño de los diagnósticos para el SARS-CoV-2, que incluye el plan de la agencia para negarse a revisar las solicitudes de AUE para LDT. Sin embargo, la FDA continuará priorizando la revisión de las solicitudes de AUE para pruebas en los sitios de atención, las pruebas de recolección en el hogar, las pruebas caseras y cualquier prueba que reduzca la dependencia de los suministros de prueba, así como pruebas de alto rendimiento y ampliamente distribuidas. Con este cambio, la FDA tiene como objetivo aumentar la accesibilidad y la capacidad de las pruebas, según las Preguntas Frecuentes actualizadas de la agencia.
“Actualmente estamos en una fase diferente de la pandemia, con respecto a las pruebas, que antes, donde muchas pruebas de COVID-19 ahora están autorizadas para procesamiento en laboratorios”, escribió la FDA. “Damos prioridad a la revisión de las solicitudes de pruebas de la AUE teniendo en cuenta una variedad de factores, incluidos los discutidos en la Autorización de Uso en Emergencias de productos médicos y la Guía de Autoridades Relacionadas, como la necesidad de salud pública del producto y la disponibilidad Autorización de Uso en Emergencias”.
Sin embargo, la Asociación Estadounidense de Laboratorios Clínicos (ACLA Washington, DC, EUA) se opuso a la decisión de la FDA de dejar de revisar las AUE para las pruebas de COVID-19 desarrolladas en laboratorio. Una declaración emitida por la presidente de la ACLA, Julie Khani, dijo: “Muchas de las pruebas a las que se les han otorgado AUE para las pruebas de COVID-19 son LDT innovadoras de alto rendimiento que han reducido la dependencia de los suministros y han sido parte integral para expandir la capacidad de análisis. Estos son exactamente los tipos de pruebas que la FDA ha declarado que quiere priorizar. ACLA cree que la FDA debería seguir permitiendo que los laboratorios presenten voluntariamente la solicitud para una AUE para su revisión y autorización. El anuncio de hoy de la FDA crea una confusión innecesaria”.
Enlace relacionado:
Administración de Alimentos y Medicamentos de EUA (FDA)
Asociación Estadounidense de Laboratorios Clínicos (ACLA)
Últimas COVID-19 noticias
- Inmunosensor nuevo allana el camino para pruebas rápidas POC para COVID-19 y enfermedades infecciosas emergentes
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Prueba nueva COVID + Influenza + VSR ayudará a estar preparados para la ‘tripledemia’
- IA elimina las conjeturas de las pruebas de flujo lateral
- Prueba de antígeno del SARS-CoV-2 más rápida, jamás diseñada, permite realizar pruebas de COVID-19 no invasivas en cualquier entorno
- Pruebas rápidas de antígeno detectan las variantes ómicron, delta del SARS-CoV-2
- Prueba en sangre realizada durante la infección inicial predice el riesgo de COVID prolongada
- Investigadores afirman que hay que crear “reservistas” de laboratorio para responder más rápidamente a la próxima pandemia
- Estudio encuentra que los profesionales sanitarios mostraron mayor interés en tecnologías POC durante la pandemia
- Plataforma de análisis de bajo costo para la COVID-19 combina sensibilidad de la PCR y velocidad de pruebas de antígeno
- Prueba de sangre por punción digital identifica inmunidad a la COVID-19
- Kit de prueba rápida determina inmunidad contra la COVID-19 y sus variantes
Canales
Química Clínica
ver canal
Simple prueba cutánea podría revolucionar el diagnóstico de esofagitis eosinofílica pediátrica
La esofagitis eosinofílica (EE) es una enfermedad crónica, causada por alérgenos alimentarios, que se caracteriza por inflamación y daño del revestimiento esofágico.... Más
Herramienta de diagnóstico portátil utiliza bioluminiscencia para detectar virus POC
Los diagnósticos en el punto de atención se han convertido en herramientas cruciales en muchos hogares, permitiendo a las personas medir la glucemia, realizar pruebas de embarazo e incluso... Más
Prueba de madurez pulmonar con IA identifica recién nacidos con mayor riesgo de dificultad respiratoria
Cada año, aproximadamente 300.000 bebés nacen en Estados Unidos entre las 32 y 36 semanas de gestación, según datos nacionales de salud. Este grupo presenta un riesgo elevado de dificultad respiratoria,... MásDiagnóstico Molecular
ver canal
Dispositivo portátil detecta mutaciones genéticas raras en una gota de sangre
Los métodos actuales de análisis genético suelen tardar días o incluso semanas en detectar mutaciones raras, lo que retrasa el diagnóstico y el tratamiento oportunos,... Más
Pruebas de sangre de ADNtc mejoran diagnóstico de cáncer de pulmón
El cáncer de pulmón sigue representando una importante carga para la salud mundial, siendo el cáncer más frecuentemente diagnosticado y la principal causa de mortalidad por... MásHematología
ver canal
Prueba de cartucho desechable ofrece resultados de hemograma rápidos y precisos
El hemograma completo (HC) es una de las pruebas de laboratorio más solicitadas, crucial para diagnosticar enfermedades, monitorear terapias y realizar exámenes de salud rutinarios.... Más
Primera prueba de monitorización de heparina POC proporciona resultados rápidos
La dosificación de heparina requiere un manejo cuidadoso para evitar complicaciones hemorrágicas y de coagulación. En situaciones de alto riesgo, como la oxigenación por membrana... MásInmunología
ver canal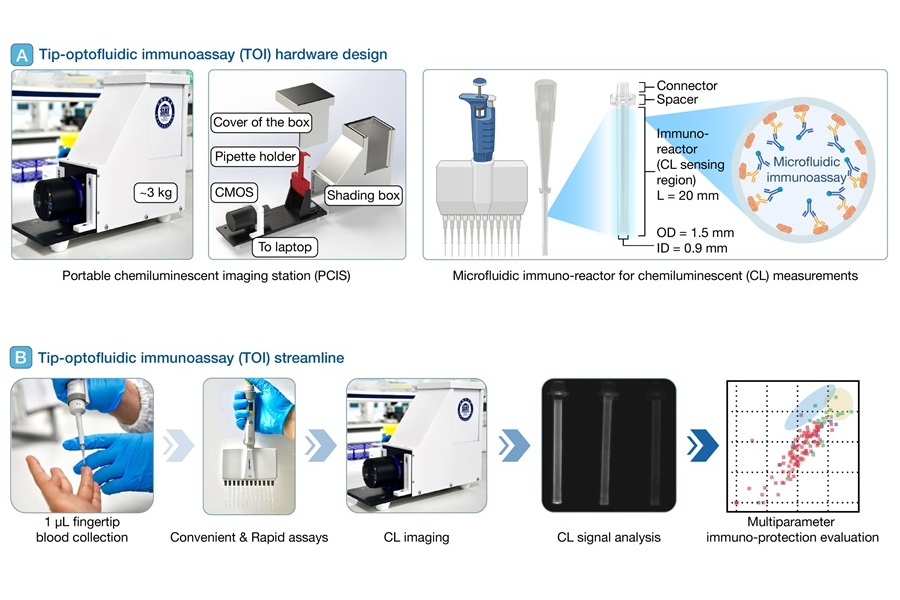
Plataforma de diagnóstico POC realiza análisis inmunológico con una gota de sangre del dedo
A medida que surgen nuevas variantes de la COVID-19 y las personas acumulan historiales complejos de vacunación e infección, existe una necesidad urgente de herramientas de diagnóstico... Más
Cambio de tratamiento guiado por biopsia líquida mejora resultados en pacientes con cáncer de mama
El tratamiento estándar para pacientes con cáncer de mama avanzado con receptor de estrógeno (RE) positivo y HER2 negativo, un subtipo impulsado por los receptores de estrógeno... Más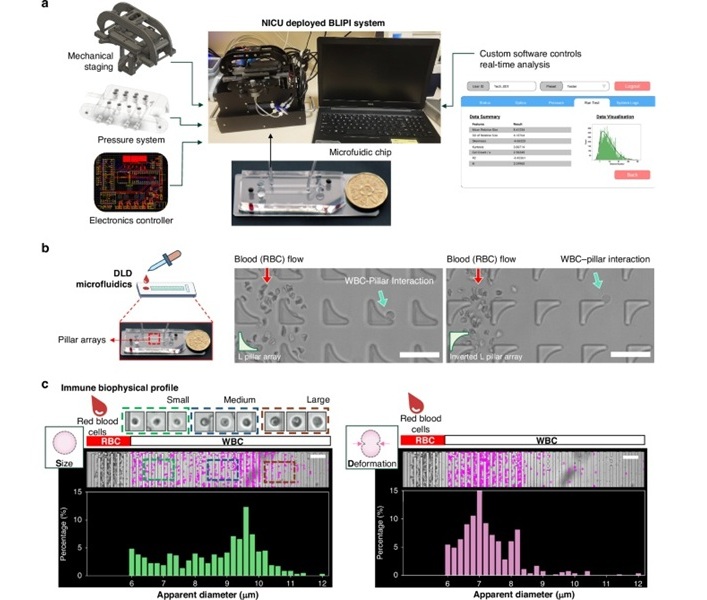
Dispositivo innovador analiza función inmunitaria de recién nacidos con una gota de sangre
Los bebés prematuros son muy susceptibles a enfermedades graves y potencialmente mortales, como la sepsis y la enterocolitis necrosante (ECN). La sepsis neonatal, una infección del torrente sanguíneo que... Más
Prueba de células madre predice resultado del tratamiento en cáncer de ovario resistente al platino
El cáncer de ovario epitelial suele responder inicialmente a la quimioterapia, pero con el tiempo, el tumor desarrolla resistencia a la terapia, lo que provoca su recrecimiento. Esta resistencia... MásMicrobiología
ver canal
Análisis de hemocultivo mejora gestión diagnóstica mediante selección de panel específico
Cada año, alrededor de 250.000 personas en los EUA son diagnosticadas con infecciones del torrente sanguíneo (ITS). La sepsis causada por estas infecciones conlleva una tasa de mortalidad... Más
Secuenciación genómica en tiempo real detecta superbacteria que causa infecciones hospitalarias
Las infecciones por superbacterias causadas por Staphylococcus aureus, o "estafilococo dorado", son notoriamente difíciles de tratar y se cobran más de un millón de vidas... MásPatología
ver canal
Modelo de IA detecta más de 170 tipos de cáncer
El diagnóstico de tumores cerebrales puede ser especialmente difícil cuando el tumor se localiza en una región donde las biopsias presentan un alto riesgo. En estos casos, donde no... Más
Prueba de hemoglobina para smartphones detecta con precisión cáncer colorrectal
A pesar de la disponibilidad de programas de detección del cáncer colorrectal, la participación sigue siendo baja, especialmente en las pruebas inmunoquímicas fecales (PIF),... MásTecnología
ver canal
Método de IA predice tasa de supervivencia de pacientes con cáncer de próstata
El adenocarcinoma de próstata (ACP) representa el 99 % de los diagnósticos de cáncer de próstata y es el segundo cáncer más común en hombres a nivel mundial,... Más
Prueba de aliento para detección temprana del cáncer de mama
Las mamografías a menudo no detectan el cáncer de mama en mujeres con tejido mamario denso, pasando por alto hasta el 60 % de los casos debido a la menor claridad de la imagen.... Más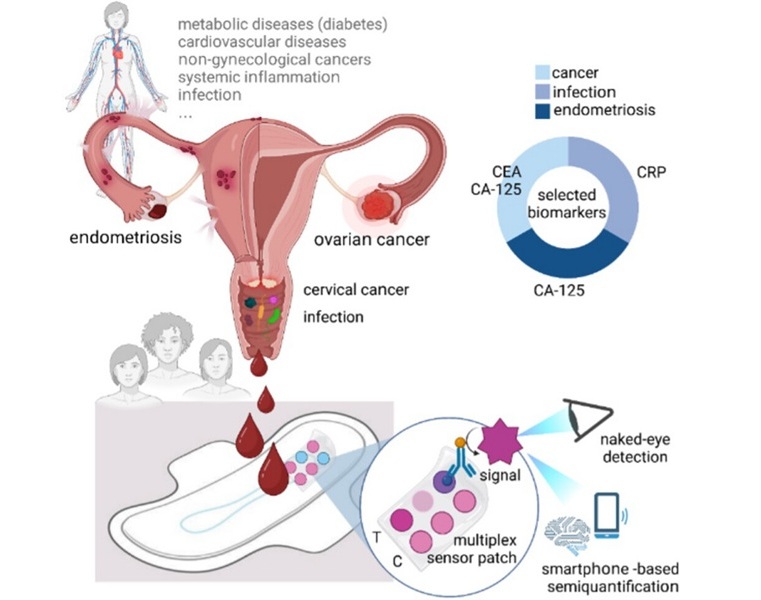
Primera tecnología reconoce biomarcadores de enfermedades directamente en sangre menstrual presente en compresas
Más de 1.800 millones de personas menstrúan en todo el mundo; sin embargo, la sangre menstrual se ha pasado por alto en gran medida en la práctica médica. Esta sangre contiene... Más
Pequeños sensores microláser con capacidad de biodetección supercargada permiten diagnóstico temprano de enfermedades
Los sensores ópticos microláser de modo galería susurrante funcionan atrapando la luz dentro de diminutas microcavidades. Cuando las moléculas diana se unen a la cavidad, inducen... MásIndustria
ver canal
Fujirebio colabora con Stanford Medicine para impulsar la investigación de enfermedades infecciosas
Fujirebio (Tokio, Japón) ha iniciado una colaboración con Stanford Medicine (Palo Alto, CA, EUA) para acelerar la adopción de inmunoensayos ultrasensibles que incorporan tecnología... Más