Análisis SARS-CoV-2 RNA STAR de LumiraDx asegura la autorización para uso en emergencias de la FDA
|
Por el equipo editorial de LabMedica en español Actualizado el 17 Aug 2020 |

Ilustración
LumiraDx (Londres, Reino Unido) obtuvo la autorización de uso en emergencias de la Administración de Medicamentos y Alimentos de los Estados Unidos (FDA) para su ensayo SARS-CoV-2 RNA STAR.
El ensayo SARS-CoV-2 RNA STAR de LumiraDx, es un kit de análisis molecular que utiliza un método qSTAR (reacción de amplificación selectiva de temperatura) de amplificación de ácido nucleico no isotérmico, destinado a la detección cualitativa de ácido nucleico del SARS-CoV-2 en muestras de las vías respiratorias superiores (como hisopados nasales, de cornete medio, nasofaríngeos y orofaríngeos) y muestras de lavado broncoalveolar, recolectadas de individuos sospechosos de COVID-19 por su proveedor de atención médica.
Se utiliza para la detección cualitativa de ARN del SARS-CoV-2 (COVID-19). La muestra del paciente se recolecta y purifica mediante procesos de extracción manuales o automáticos estándar. Luego, la muestra se agrega a la Muestra Maestra donde se transcribe a ADNc. Si el virus está presente en la muestra, será amplificado por la tecnología qSTAR en aproximadamente 12 minutos. Tras la rápida amplificación del virus, la diana se detecta específicamente con balizas moleculares y los resultados son informados como positivos o negativos.
La extracción de ácido nucleico se realiza utilizando el kit QIAsymphony DSP Virus/Pathogen de Qiagen y el instrumento automatizado QIAsymphony SP o manualmente mediante el kit de aislamiento de ácido nucleico de patógenos y virus, MagMax, de Thermo Fisher o el minikit de QIAamp Viral RNA de Qiagen. La prueba se puede procesar en una variedad de instrumentos, incluidos el LightCycler 480 II de Roche, Applied Biosystems 7500 Fast Dx y QuantStudio 5 de Thermo Fisher, y AriaMx y Stratagene Mx3005P de Agilent. El ensayo LumiraDx SARS-CoV-2 RNA STAR fue validado a partir de muestras comunes del tracto respiratorio superior en Medio de Transporte Universal.
Enlace relacionado:
LumiraDx
El ensayo SARS-CoV-2 RNA STAR de LumiraDx, es un kit de análisis molecular que utiliza un método qSTAR (reacción de amplificación selectiva de temperatura) de amplificación de ácido nucleico no isotérmico, destinado a la detección cualitativa de ácido nucleico del SARS-CoV-2 en muestras de las vías respiratorias superiores (como hisopados nasales, de cornete medio, nasofaríngeos y orofaríngeos) y muestras de lavado broncoalveolar, recolectadas de individuos sospechosos de COVID-19 por su proveedor de atención médica.
Se utiliza para la detección cualitativa de ARN del SARS-CoV-2 (COVID-19). La muestra del paciente se recolecta y purifica mediante procesos de extracción manuales o automáticos estándar. Luego, la muestra se agrega a la Muestra Maestra donde se transcribe a ADNc. Si el virus está presente en la muestra, será amplificado por la tecnología qSTAR en aproximadamente 12 minutos. Tras la rápida amplificación del virus, la diana se detecta específicamente con balizas moleculares y los resultados son informados como positivos o negativos.
La extracción de ácido nucleico se realiza utilizando el kit QIAsymphony DSP Virus/Pathogen de Qiagen y el instrumento automatizado QIAsymphony SP o manualmente mediante el kit de aislamiento de ácido nucleico de patógenos y virus, MagMax, de Thermo Fisher o el minikit de QIAamp Viral RNA de Qiagen. La prueba se puede procesar en una variedad de instrumentos, incluidos el LightCycler 480 II de Roche, Applied Biosystems 7500 Fast Dx y QuantStudio 5 de Thermo Fisher, y AriaMx y Stratagene Mx3005P de Agilent. El ensayo LumiraDx SARS-CoV-2 RNA STAR fue validado a partir de muestras comunes del tracto respiratorio superior en Medio de Transporte Universal.
Enlace relacionado:
LumiraDx
Últimas COVID-19 noticias
- Inmunosensor nuevo allana el camino para pruebas rápidas POC para COVID-19 y enfermedades infecciosas emergentes
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Prueba nueva COVID + Influenza + VSR ayudará a estar preparados para la ‘tripledemia’
- IA elimina las conjeturas de las pruebas de flujo lateral
- Prueba de antígeno del SARS-CoV-2 más rápida, jamás diseñada, permite realizar pruebas de COVID-19 no invasivas en cualquier entorno
- Pruebas rápidas de antígeno detectan las variantes ómicron, delta del SARS-CoV-2
- Prueba en sangre realizada durante la infección inicial predice el riesgo de COVID prolongada
- Investigadores afirman que hay que crear “reservistas” de laboratorio para responder más rápidamente a la próxima pandemia
- Estudio encuentra que los profesionales sanitarios mostraron mayor interés en tecnologías POC durante la pandemia
- Plataforma de análisis de bajo costo para la COVID-19 combina sensibilidad de la PCR y velocidad de pruebas de antígeno
- Prueba de sangre por punción digital identifica inmunidad a la COVID-19
- Kit de prueba rápida determina inmunidad contra la COVID-19 y sus variantes
Canales
Química Clínica
ver canal
Análisis de sangre con IA detecta cáncer de ovario
El cáncer de ovario se ubica como la quinta causa principal de muerte por cáncer en mujeres, debido principalmente a diagnósticos en etapas tardías. Si bien más del 90... Más
Ensayo automatizado y descentralizado de NGS deADNlc identifica alteraciones en tumores sólidos avanzados
Los análisis actuales de ADN libre circulante (ADNlc) suelen estar centralizados, lo que requiere un manejo y transporte especializados de las muestras. La introducción de un sistema de ... MásDiagnóstico Molecular
ver canal
Innovadora prueba de diagnóstico molecular señala con precisión principal causa genética de EPOC
La enfermedad pulmonar obstructiva crónica (EPOC) y la deficiencia de alfa-1 antitripsina (DAAT) son afecciones que pueden causar dificultades respiratorias, pero difieren en su origen y herencia.... Más
Prueba diagnóstica de sangre detecta espondiloartritis axial
La espondiloartritis axial (EspAax) es una enfermedad autoinmune inflamatoria crónica que suele afectar a las personas durante sus años más productivos, y cuyos síntomas suelen manifestarse antes de los 45 años.... MásHematología
ver canal
Primera prueba de monitorización de heparina POC proporciona resultados rápidos
La dosificación de heparina requiere un manejo cuidadoso para evitar complicaciones hemorrágicas y de coagulación. En situaciones de alto riesgo, como la oxigenación por membrana... Más
Nuevo sistema de puntuación predice riesgo de cáncer a partir de un trastorno sanguíneo común
La citopenia clonal de significado incierto (CCSI) es un trastorno sanguíneo común en adultos mayores, caracterizado por mutaciones en las células sanguíneas y un recuento ... MásInmunología
ver canal
Prueba de células madre predice resultado del tratamiento en cáncer de ovario resistente al platino
El cáncer de ovario epitelial suele responder inicialmente a la quimioterapia, pero con el tiempo, el tumor desarrolla resistencia a la terapia, lo que provoca su recrecimiento. Esta resistencia... Más
Análisis de sangre con aprendizaje automático predice respuesta a inmunoterapia en pacientes con linfoma
La terapia de células T con receptores de antígenos quiméricos (CAR) se ha convertido en uno de los avances recientes más prometedores en el tratamiento de los cánceres... MásMicrobiología
ver canal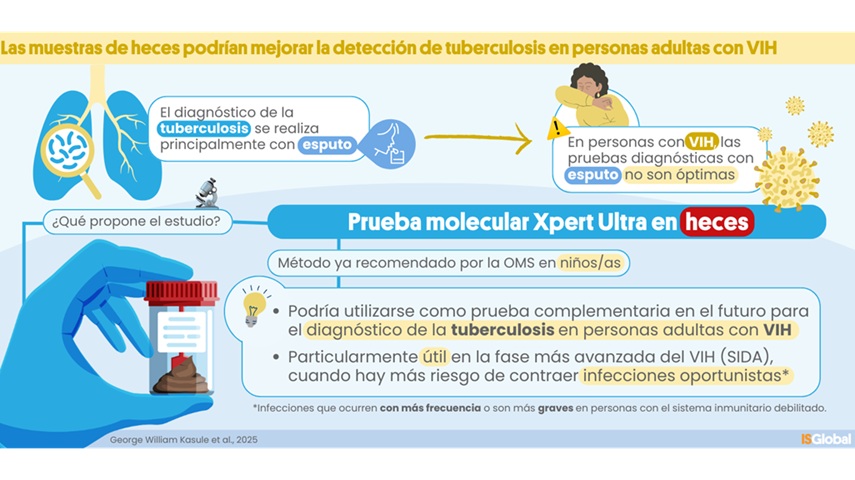
Prueba molecular de heces muestra potencial para diagnosticar tuberculosis en adultos con VIH
La tuberculosis (TB), causada por la bacteria Mycobacterium tuberculosis, provocó 1,25 millones de muertes en 2023, de las cuales el 13 % se produjeron en personas con VIH. El principal método... Más
Nueva prueba diagnostica meningitis bacteriana con rapidez y precisión
La meningitis bacteriana es una afección potencialmente mortal: uno de cada seis pacientes fallece y la mitad de los supervivientes experimentan síntomas persistentes. Por lo tanto, un d... MásPatología
ver canal
Innovador algoritmo de triaje del dolor torácico transforma la atención cardíaca
Las enfermedades cardiovasculares son responsables de un tercio de las muertes en todo el mundo, y el dolor torácico es la segunda causa más común de visitas a urgencias.... Más
Enfoque de biopsia líquida basado en IA revolucionará detección del cáncer cerebral
Detectar cánceres cerebrales sigue siendo extremadamente difícil, ya que muchos pacientes solo reciben un diagnóstico en etapas avanzadas, tras la aparición de síntomas... MásTecnología
ver canal
Algoritmos predictivos avanzados identifican pacientes con cáncer no diagnosticado
Dos algoritmos predictivos avanzados recientemente desarrollados aprovechan el estado de salud de una persona y los resultados de análisis de sangre básicos para predecir con precisión... Más
Algoritmo de firma de luz permite diagnósticos médicos más rápidos y precisos
Cada material o molécula interactúa con la luz de forma única, creando un patrón distintivo, similar a una huella dactilar. La espectroscopia óptica, que consiste en... MásIndustria
ver canal
Cepheid y Oxford Nanopore se unen para desarrollar soluciones con secuenciación automatizada
Cepheid (Sunnyvale, CA, EUA), una empresa líder en diagnóstico molecular, y Oxford Nanopore Technologies (Oxford, Reino Unido), la empresa detrás de una nueva generación de... Más