Política revisada de la FDA hace más estrictos los requisitos para las pruebas de anticuerpos para la COVID-19
|
Por el equipo editorial de LabMedica en español Actualizado el 07 May 2020 |
Ilustración
La Administración de Medicamentos y Alimentos de los Estados Unidos {(FDA) Silver Spring, MD, EUA} actualizó su política sobre pruebas de anticuerpos para la COVID-19, vigente desde el 16 de marzo de 2020, ajustando los requisitos para tales pruebas.
Cuando la FDA emitió su política del 16 de marzo, era más apropiado un nivel más alto de flexibilidad para las pruebas de anticuerpos que para las pruebas moleculares que detectan la presencia del virus que causa la COVID-19, ya que las pruebas de anticuerpos no están destinadas para el diagnóstico de las infecciones activas por el SARS-CoV-2. Esta flexibilidad en la política de la FDA del 16 de marzo permitió el uso temprano de pruebas de anticuerpos para comenzar a responder preguntas críticas a nivel de población sobre la prevalencia de infecciones por SARS-CoV-2 en diferentes comunidades y si la presencia de anticuerpos transmite inmunidad y, de ser así, por cuanto tiempo.
Sin embargo, la FDA continúa adaptándose en función de la experiencia y los datos del mundo real y, por lo tanto, a medida que autorizó más pruebas de anticuerpos y datos de validación disponibles, el cuidadoso equilibrio de riesgos y beneficios cambió desde donde estaba a mediados de marzo. Por lo tanto, la FDA realizó un cambio importante en su política del 16 de marzo con respecto a la revisión de la FDA para las pruebas de serología de los fabricantes comerciales. Según la política revisada, la FDA ahora requiere que los fabricantes comerciales de pruebas de anticuerpos presenten solicitudes de autorización de uso en emergencias (AUE), con sus datos de validación, dentro de los 10 días hábiles siguientes a la fecha en que notificaron a la FDA de sus pruebas de validación, o desde la fecha de esta política, lo que sea posterior. Además, la FDA proporcionó recomendaciones específicas de umbral de rendimiento para especificidad y sensibilidad para todos los desarrolladores de pruebas de serología.
Los laboratorios de alta complejidad que desarrollan sus propias pruebas, también llamadas Pruebas desarrolladas en laboratorio o LDT, deben seguir contando con un certificado CLIA (proporcionado por los CMS) para desarrollar legalmente una prueba de serología. Además, según la política descrita por la FDA, deben realizar su propia validación y notificar a la FDA, además de seguir otras recomendaciones de etiquetado, descritas en la política del 16 de marzo. Se alienta a los desarrolladores de LDT a buscar autorización a través de una AUE.
Además de actualizar la política, la FDA introdujo un proceso más simplificado para respaldar los envíos y la revisión de las AUE. Se han puesto a disposición dos plantillas voluntarias de AUE para las pruebas de anticuerpos: una para fabricantes comerciales y otra para laboratorios de alta complejidad certificados por CLIA que deciden solicitar la autorización de la FDA. Estas plantillas facilitarán la preparación y presentación de una solicitud de AUE y pueden ser utilizadas por cualquier desarrollador interesado.
Enlace relacionado:
Administración de Medicamentos y Alimentos de los Estados Unidos
Cuando la FDA emitió su política del 16 de marzo, era más apropiado un nivel más alto de flexibilidad para las pruebas de anticuerpos que para las pruebas moleculares que detectan la presencia del virus que causa la COVID-19, ya que las pruebas de anticuerpos no están destinadas para el diagnóstico de las infecciones activas por el SARS-CoV-2. Esta flexibilidad en la política de la FDA del 16 de marzo permitió el uso temprano de pruebas de anticuerpos para comenzar a responder preguntas críticas a nivel de población sobre la prevalencia de infecciones por SARS-CoV-2 en diferentes comunidades y si la presencia de anticuerpos transmite inmunidad y, de ser así, por cuanto tiempo.
Sin embargo, la FDA continúa adaptándose en función de la experiencia y los datos del mundo real y, por lo tanto, a medida que autorizó más pruebas de anticuerpos y datos de validación disponibles, el cuidadoso equilibrio de riesgos y beneficios cambió desde donde estaba a mediados de marzo. Por lo tanto, la FDA realizó un cambio importante en su política del 16 de marzo con respecto a la revisión de la FDA para las pruebas de serología de los fabricantes comerciales. Según la política revisada, la FDA ahora requiere que los fabricantes comerciales de pruebas de anticuerpos presenten solicitudes de autorización de uso en emergencias (AUE), con sus datos de validación, dentro de los 10 días hábiles siguientes a la fecha en que notificaron a la FDA de sus pruebas de validación, o desde la fecha de esta política, lo que sea posterior. Además, la FDA proporcionó recomendaciones específicas de umbral de rendimiento para especificidad y sensibilidad para todos los desarrolladores de pruebas de serología.
Los laboratorios de alta complejidad que desarrollan sus propias pruebas, también llamadas Pruebas desarrolladas en laboratorio o LDT, deben seguir contando con un certificado CLIA (proporcionado por los CMS) para desarrollar legalmente una prueba de serología. Además, según la política descrita por la FDA, deben realizar su propia validación y notificar a la FDA, además de seguir otras recomendaciones de etiquetado, descritas en la política del 16 de marzo. Se alienta a los desarrolladores de LDT a buscar autorización a través de una AUE.
Además de actualizar la política, la FDA introdujo un proceso más simplificado para respaldar los envíos y la revisión de las AUE. Se han puesto a disposición dos plantillas voluntarias de AUE para las pruebas de anticuerpos: una para fabricantes comerciales y otra para laboratorios de alta complejidad certificados por CLIA que deciden solicitar la autorización de la FDA. Estas plantillas facilitarán la preparación y presentación de una solicitud de AUE y pueden ser utilizadas por cualquier desarrollador interesado.
Enlace relacionado:
Administración de Medicamentos y Alimentos de los Estados Unidos
Últimas COVID-19 noticias
- Inmunosensor nuevo allana el camino para pruebas rápidas POC para COVID-19 y enfermedades infecciosas emergentes
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Prueba nueva COVID + Influenza + VSR ayudará a estar preparados para la ‘tripledemia’
- IA elimina las conjeturas de las pruebas de flujo lateral
- Prueba de antígeno del SARS-CoV-2 más rápida, jamás diseñada, permite realizar pruebas de COVID-19 no invasivas en cualquier entorno
- Pruebas rápidas de antígeno detectan las variantes ómicron, delta del SARS-CoV-2
- Prueba en sangre realizada durante la infección inicial predice el riesgo de COVID prolongada
- Investigadores afirman que hay que crear “reservistas” de laboratorio para responder más rápidamente a la próxima pandemia
- Estudio encuentra que los profesionales sanitarios mostraron mayor interés en tecnologías POC durante la pandemia
- Plataforma de análisis de bajo costo para la COVID-19 combina sensibilidad de la PCR y velocidad de pruebas de antígeno
- Prueba de sangre por punción digital identifica inmunidad a la COVID-19
- Kit de prueba rápida determina inmunidad contra la COVID-19 y sus variantes
Canales
Química Clínica
ver canal
Herramienta química a nanoescala 'brillantemente luminosa' mejora detección de enfermedades
Miles de moléculas brillantes disponibles comercialmente, conocidas como fluoróforos, se utilizan comúnmente en imágenes médicas, detección de enfermedades, marcado... Más
Prueba de detección portátil económica transforma detección de enfermedades renales
Millones de personas padecen enfermedad renal, que a menudo permanece sin diagnosticar hasta que alcanza una etapa crítica. Esta epidemia silenciosa no solo disminuye la calidad de vida de los afectados,... MásDiagnóstico Molecular
ver canal
Prueba de sangre única detecta enfermedades relacionadas con traumatismos
En el acelerado mundo actual, el estrés y el trauma se han convertido, lamentablemente, en experiencias comunes para muchas personas. La exposición continua a las hormonas del estrés... Más
Gen clave identificado en enfermedad cardíaca común revela potencial diagnóstico que salva vidas
La miocardiopatía hipertrófica (MCH) es la cardiopatía hereditaria más prevalente a nivel mundial, afectando aproximadamente a 1 de cada 200 personas y siendo una de las principales... MásHematología
ver canal
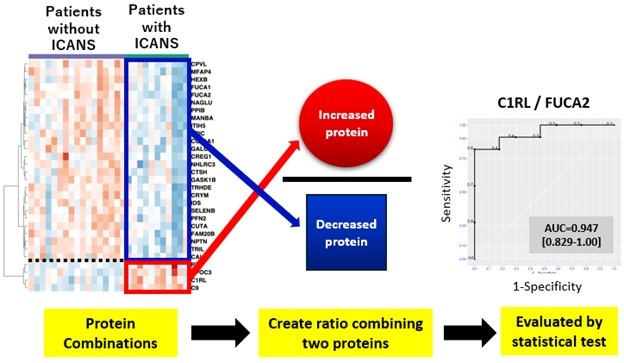
Nuevo sistema de puntuación predice riesgo de cáncer a partir de un trastorno sanguíneo común
La citopenia clonal de significado incierto (CCSI) es un trastorno sanguíneo común en adultos mayores, caracterizado por mutaciones en las células sanguíneas y un recuento ... Más
Prueba prenatal no invasiva para determinar estado RhD del feto es 100 % precisa
En los Estados Unidos, aproximadamente el 15 % de las embarazadas son RhD negativas. Sin embargo, en aproximadamente el 40 % de estos casos, el feto también es RhD negativo, lo que hace innecesaria la... MásInmunología
ver canal
Prueba de células madre predice resultado del tratamiento en cáncer de ovario resistente al platino
El cáncer de ovario epitelial suele responder inicialmente a la quimioterapia, pero con el tiempo, el tumor desarrolla resistencia a la terapia, lo que provoca su recrecimiento. Esta resistencia... Más
Análisis de sangre con aprendizaje automático predice respuesta a inmunoterapia en pacientes con linfoma
La terapia de células T con receptores de antígenos quiméricos (CAR) se ha convertido en uno de los avances recientes más prometedores en el tratamiento de los cánceres... MásMicrobiología
ver canal
Dispositivo portátil ofrece resultados de tuberculosis económico y rápido
La tuberculosis (TB) sigue siendo la enfermedad infecciosa más mortal a nivel mundial, afectando a aproximadamente 10 millones de personas al año. En 2021, alrededor de 4,2 millones de casos... Más
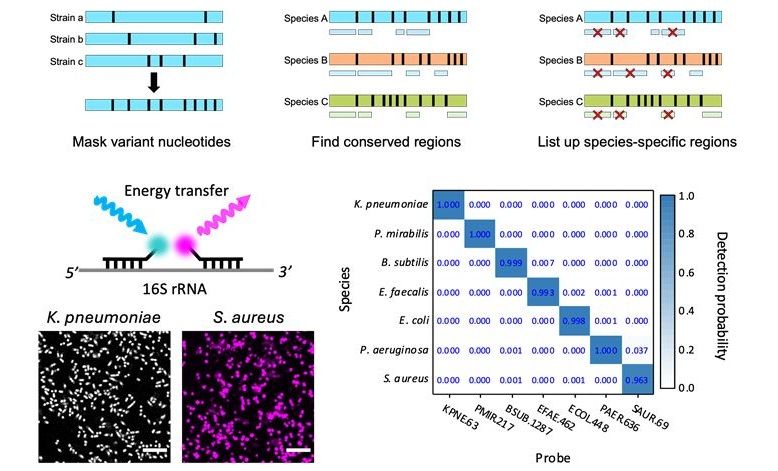
Método basado en IA mejora diagnóstico de infecciones resistentes a fármacos
Las infecciones resistentes a los medicamentos, en particular las causadas por bacterias mortales como la tuberculosis y el estafilococo, se están convirtiendo rápidamente en una emergencia... MásPatología
ver canal
Enfoque diagnóstico innovador mejora significativamente la detección de tuberculosis
La tuberculosis (TB) sigue siendo la enfermedad infecciosa más mortal a nivel mundial, con 10,8 millones de casos nuevos y 1,25 millones de muertes reportadas en 2023. La detección temprana... Más
Método de detección rápido, ultrasensible y sin PCR hace el análisis genético más accesible
Las pruebas genéticas han sido un método importante para detectar enfermedades infecciosas, diagnosticar cáncer en etapa temprana, garantizar la seguridad alimentaria y analizar ADN ambiental.... MásTecnología
ver canal
Tecnología de microchip desechable podría detectar selectivamente VIH en muestras de sangre completa
A finales de 2023, aproximadamente 40 millones de personas en todo el mundo vivían con VIH, y alrededor de 630.000 personas murieron por enfermedades relacionadas con el sida ese mismo año.... Más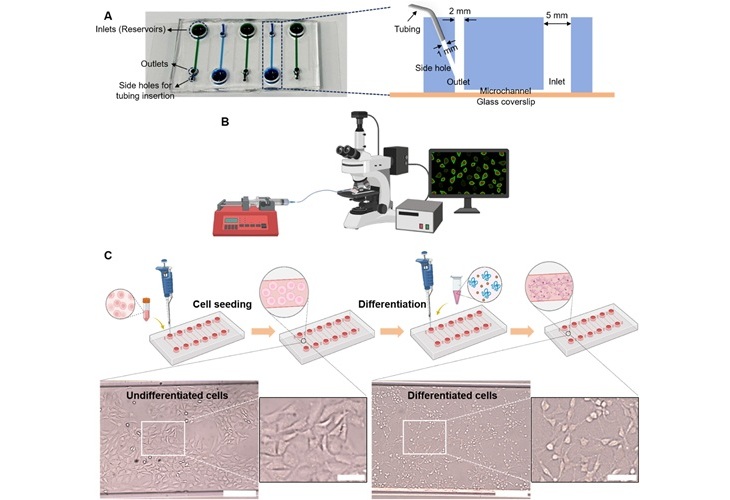
Dispositivo microfluídico Dolor en un Chip determina tipos de dolor crónico desde muestras de sangre
El dolor crónico es una afección generalizada que sigue siendo difícil de controlar, y los métodos clínicos existentes para su tratamiento se basan en gran medida en... MásIndustria
ver canal
Cepheid y Oxford Nanopore se unen para desarrollar soluciones con secuenciación automatizada
Cepheid (Sunnyvale, CA, EUA), una empresa líder en diagnóstico molecular, y Oxford Nanopore Technologies (Oxford, Reino Unido), la empresa detrás de una nueva generación de... Más