Pfizer y BioNTech presentan a la FDA una solicitud de autorización de uso de emergencia para una vacuna contra COVID-19
|
Por el equipo editorial de LabMedica en español Actualizado el 25 Nov 2020 |

Ilustración
Pfizer Inc. (Nueva York, NY, EUA) y Biopharmaceutical New Technologies (BioNTech Maguncia, Alemania) presentaron a la Dirección de Medicamentos y Alimentos de EUA (FDA) una solicitud para la Autorización para Uso en Emergencias (AUE) de su prospecto de vacuna de ARNm contra el SARS-CoV-2, BNT162b2.
Esto podría permitir el uso de dicha vacuna en poblaciones de alto riesgo de los EUA, hacia mediados o finales de diciembre de 2020. La solicitud se basa en que se demostró una tasa de eficacia de la vacuna del 95% en el estudio clínico de fase 3 de esas empresas, en participantes sin infección por SARS-CoV-2 (primer objetivo primario) y también en participantes con y sin infección previa por SARS-CoV-2 (segundo objetivo primario), medidas en cada grupo siete días después de la segunda dosis. El análisis del primer objetivo principal se basó en 170 casos confirmados de COVID-19. Dicha solicitud también está respaldada por datos de seguridad solicitados de un subconjunto aleatorizado de aproximadamente 8.000 participantes mayores de 18 años y datos de seguridad no solicitados de aproximadamente 38.000 participantes del estudio a quienes se les ha hecho seguimiento durante una mediana de dos meses después de la segunda dosis del prospecto de vacuna. La solicitud también incluye datos de seguridad solicitados de cerca de 100 niños de 12 a 15 años. Hasta la fecha, el Comité de Monitoreo de Datos (DMC) del estudio no ha reportado ningún problema de seguridad serio relacionado con la vacuna.
Las empresas ya han iniciado solicitudes continuas ante varias agencias reguladoras de todo el mundo, como la EMA y la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) del Reino Unido, y tienen la intención de enviar solicitudes a otras agencias reguladoras en todo el mundo en los próximos días. En algunos casos, los gobiernos pueden tener recursos regulatorios similares a una AUE. Las empresas estarán listas para distribuir su prospecto de vacuna pocas horas después de ser autorizadas. La red de fabricación combinada de Pfizer y BioNTech tiene el potencial de suministrar hasta 50 millones de dosis de vacunas a nivel mundial en 2020 y hasta 1.300 millones de dosis para fines de 2021 (dependiendo del éxito clínico, la capacidad de fabricación y la aprobación o autorización regulatoria).
“Nuestro trabajo para ofrecer una vacuna segura y eficaz nunca ha sido más urgente, ya que seguimos viendo un aumento alarmante en el número de casos de COVID-19 a nivel mundial. La solicitud en los EUA representa un hito crítico en nuestro viaje para entregarle al mundo una vacuna contra la COVID-19 y ahora tenemos una imagen más completa de la eficacia y del perfil de seguridad de nuestra vacuna, lo cual nos da confianza en su potencial”, dijo el Dr. Albert Bourla, presidente y director ejecutivo de Pfizer. "Esperamos con interés la próxima discusión del Comité Asesor de Vacunas y Productos Biológicos Relacionados y continuamos nuestro trabajo en estrecha colaboración con la FDA y las autoridades reguladoras de todo el mundo para asegurar la autorización de nuestro prospecto de vacuna, lo más pronto posible".
“Solicitar una Autorización para Uso en Emergencias en los EUA, es un paso fundamental para que nuestro prospecto de vacuna esté disponible para la población mundial lo más pronto posible”, dijo Ugur Sahin, M.D., director ejecutivo y cofundador de BioNTech. “Tenemos la intención de continuar trabajando con las agencias reguladoras en todo el mundo para obtener la distribución rápida de nuestra vacuna a nivel mundial. Como empresa ubicada en Alemania, en el corazón de Europa, nuestras interacciones con la Agencia Europea de Medicamentos (EMA) son de particular importancia para nosotros y les hemos proporcionado datos continuamente como parte de nuestro proceso de revisión continua".
Enlace relacionado:
Biopharmaceutical New Technologies
Esto podría permitir el uso de dicha vacuna en poblaciones de alto riesgo de los EUA, hacia mediados o finales de diciembre de 2020. La solicitud se basa en que se demostró una tasa de eficacia de la vacuna del 95% en el estudio clínico de fase 3 de esas empresas, en participantes sin infección por SARS-CoV-2 (primer objetivo primario) y también en participantes con y sin infección previa por SARS-CoV-2 (segundo objetivo primario), medidas en cada grupo siete días después de la segunda dosis. El análisis del primer objetivo principal se basó en 170 casos confirmados de COVID-19. Dicha solicitud también está respaldada por datos de seguridad solicitados de un subconjunto aleatorizado de aproximadamente 8.000 participantes mayores de 18 años y datos de seguridad no solicitados de aproximadamente 38.000 participantes del estudio a quienes se les ha hecho seguimiento durante una mediana de dos meses después de la segunda dosis del prospecto de vacuna. La solicitud también incluye datos de seguridad solicitados de cerca de 100 niños de 12 a 15 años. Hasta la fecha, el Comité de Monitoreo de Datos (DMC) del estudio no ha reportado ningún problema de seguridad serio relacionado con la vacuna.
Las empresas ya han iniciado solicitudes continuas ante varias agencias reguladoras de todo el mundo, como la EMA y la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) del Reino Unido, y tienen la intención de enviar solicitudes a otras agencias reguladoras en todo el mundo en los próximos días. En algunos casos, los gobiernos pueden tener recursos regulatorios similares a una AUE. Las empresas estarán listas para distribuir su prospecto de vacuna pocas horas después de ser autorizadas. La red de fabricación combinada de Pfizer y BioNTech tiene el potencial de suministrar hasta 50 millones de dosis de vacunas a nivel mundial en 2020 y hasta 1.300 millones de dosis para fines de 2021 (dependiendo del éxito clínico, la capacidad de fabricación y la aprobación o autorización regulatoria).
“Nuestro trabajo para ofrecer una vacuna segura y eficaz nunca ha sido más urgente, ya que seguimos viendo un aumento alarmante en el número de casos de COVID-19 a nivel mundial. La solicitud en los EUA representa un hito crítico en nuestro viaje para entregarle al mundo una vacuna contra la COVID-19 y ahora tenemos una imagen más completa de la eficacia y del perfil de seguridad de nuestra vacuna, lo cual nos da confianza en su potencial”, dijo el Dr. Albert Bourla, presidente y director ejecutivo de Pfizer. "Esperamos con interés la próxima discusión del Comité Asesor de Vacunas y Productos Biológicos Relacionados y continuamos nuestro trabajo en estrecha colaboración con la FDA y las autoridades reguladoras de todo el mundo para asegurar la autorización de nuestro prospecto de vacuna, lo más pronto posible".
“Solicitar una Autorización para Uso en Emergencias en los EUA, es un paso fundamental para que nuestro prospecto de vacuna esté disponible para la población mundial lo más pronto posible”, dijo Ugur Sahin, M.D., director ejecutivo y cofundador de BioNTech. “Tenemos la intención de continuar trabajando con las agencias reguladoras en todo el mundo para obtener la distribución rápida de nuestra vacuna a nivel mundial. Como empresa ubicada en Alemania, en el corazón de Europa, nuestras interacciones con la Agencia Europea de Medicamentos (EMA) son de particular importancia para nosotros y les hemos proporcionado datos continuamente como parte de nuestro proceso de revisión continua".
Enlace relacionado:
Biopharmaceutical New Technologies
Últimas COVID-19 noticias
- Inmunosensor nuevo allana el camino para pruebas rápidas POC para COVID-19 y enfermedades infecciosas emergentes
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Prueba nueva COVID + Influenza + VSR ayudará a estar preparados para la ‘tripledemia’
- IA elimina las conjeturas de las pruebas de flujo lateral
- Prueba de antígeno del SARS-CoV-2 más rápida, jamás diseñada, permite realizar pruebas de COVID-19 no invasivas en cualquier entorno
- Pruebas rápidas de antígeno detectan las variantes ómicron, delta del SARS-CoV-2
- Prueba en sangre realizada durante la infección inicial predice el riesgo de COVID prolongada
- Investigadores afirman que hay que crear “reservistas” de laboratorio para responder más rápidamente a la próxima pandemia
- Estudio encuentra que los profesionales sanitarios mostraron mayor interés en tecnologías POC durante la pandemia
- Plataforma de análisis de bajo costo para la COVID-19 combina sensibilidad de la PCR y velocidad de pruebas de antígeno
- Prueba de sangre por punción digital identifica inmunidad a la COVID-19
- Kit de prueba rápida determina inmunidad contra la COVID-19 y sus variantes
Canales
Química Clínica
ver canal.jpg)
Prueba biomédica POC hace girar una gota de agua utilizando ondas sonoras para detección del cáncer
Los exosomas, pequeñas biopartículas celulares que transportan un conjunto específico de proteínas, lípidos y materiales genéticos, desempeñan un papel... Más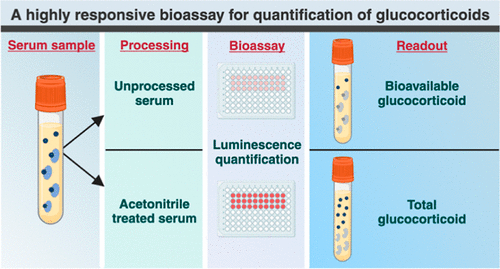
Prueba basada en células altamente confiable permite diagnóstico preciso de enfermedades endocrinas
Los métodos convencionales para medir el cortisol libre, la hormona del estrés del cuerpo, en la sangre o la saliva son bastante exigentes y requieren el procesamiento de muestras. Por lo tanto, el método... MásDiagnóstico Molecular
ver canal
Analizador de pruebas sindrómicas actualizado permite acceso remoto a resultados de pruebas
QIAGEN (Venlo, Países Bajos) ha lanzado el analizador QIAstat-Dx 2.0, incluida la actualización del software 1.6. Esto representa un avance significativo con respecto al analizador QIAstat-Dx 1.... Más
Prueba de PCR para infecciones respiratorias y de garganta detecta múltiples patógenos con síntomas coincidentes
La pandemia de COVID-19 ha demostrado la necesidad de que los profesionales de la salud tengan pruebas de diagnóstico disponibles lo más cerca posible del paciente, proporcionando resultados... Más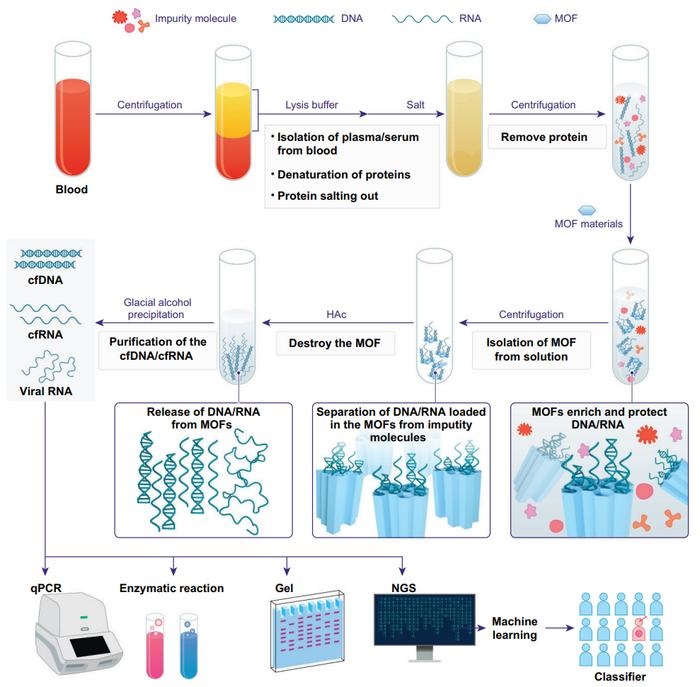
Técnica de enriquecimiento de ácido nucleico circulante en sangre permite diagnóstico no invasivo del cáncer de hígado
La capacidad de diagnosticar enfermedades de forma temprana puede optimizar significativamente la eficacia de los tratamientos clínicos y mejorar las tasas de supervivencia. Un enfoque prometedor... Más
Primera prueba molecular aprobada por la FDA para detectar malaria en donantes de sangre podría mejorar seguridad del paciente
La malaria, una enfermedad grave que a menudo provoca la muerte, se transmite por una especie específica de mosquito que infecta a los humanos con un parásito. Otros modos de transmisión... MásHematología
ver canal
Prueba de sangre POC por punción digital determina riesgo de sepsis neutropénica en pacientes sometidos a quimioterapia
La neutropenia, una disminución de los neutrófilos (un tipo de glóbulo blanco crucial para combatir las infecciones), es un efecto secundario frecuente de ciertos tratamientos contra... Más
Primera prueba rápida y asequible para beta talasemia demuestra precisión diagnóstica del 99 %
Los trastornos de la hemoglobina se encuentran entre las enfermedades monogénicas más prevalentes a nivel mundial. Entre los diversos trastornos de la hemoglobina, la beta talasemia, un trastorno sanguíneo... MásRastreador portátil de glóbulos blancos podría permitir pruebas rápidas de infecciones
Los glóbulos blancos, o leucocitos, son indicadores clave de la salud del sistema inmunológico de un individuo. Los recuentos altos o bajos de leucocitos pueden indicar la gravedad de una infección, indicar... MásAnalizador hematológico optofluídico inteligente del tamaño de la palma de la mano permite realizar pruebas POC de células sanguíneas del paciente
Las variaciones en la concentración de células sanguíneas pueden ser indicativas de varias condiciones de salud, incluidas infecciones, enfermedades inflamatorias, trastornos sanguíneos... MásInmunología
ver canal
Método de prueba podría ayudar a más pacientes recibir tratamiento adecuado contra el cáncer
El tratamiento del cáncer no siempre es una solución única, pero el campo de la investigación del cáncer está dando grandes pasos para encontrar a los pacientes los tratamientos más eficaces para sus afecciones... Más
Prueba innovadora monitorea toxicidad de radioterapia en pacientes con cáncer
La concentración de ADN libre de células circulante (ADNlc) en el torrente sanguíneo es un indicador importante que puede ayudar a rastrear qué tan bien están funcionando... MásMicrobiología
ver canal
Análisis de sangre predice sepsis e insuficiencia orgánica en niños
La sepsis plantea un riesgo grave en el que una reacción inmune grave a la infección provoca daño a los órganos. Identificar la sepsis en niños es complejo ya que los... Más
Análisis de sangre para tuberculosis podría detectar millones de propagadores silenciosos
La tuberculosis (TB) es la enfermedad infecciosa más mortal del mundo y se cobra más de un millón de vidas al año, según informa la Organización Mundial de la Salud.... Más
Un análisis de sangre simple combinado con un modelo de riesgo personalizado mejora el diagnóstico de sepsis
La sepsis, una afección crítica que surge de la disfunción orgánica debido a una infección grave, puede progresar a una sepsis grave y un shock séptico, lo que provoca insuficiencia multiorgánica y un... Más
Nuevo análisis de sangre reduce tiempo de diagnóstico de infecciones por micobacterias no tuberculosas de meses a horas
Respirar micobacterias no tuberculosas (MNT) es una experiencia común para muchas personas. Estas bacterias están presentes en los sistemas de agua, el suelo y el polvo de todo el mundo y,... MásPatología
ver canal
Primera técnica identifica células cancerosas individuales en sangre para tratamientos específicos
La comunidad médica mundial reconoce cada vez más que la biopsia líquida es un enfoque transformador para mejorar la atención al paciente con cáncer. Este innovador método... Más
Innovador dispositivo de extracción de sangre supera obstáculos comunes relacionados con la flebotomía
La incomodidad asociada con las extracciones de sangre tradicionales genera un problema importante: aproximadamente el 30 % de las pruebas de diagnóstico prescritas por los médicos nunca... Más
Dispositivo POC intraoperatorio distingue entre quistes ováricos benignos y malignos en 15 minutos
Los quistes ováricos representan un problema de salud importante para las mujeres en todo el mundo, y hasta el 10 % experimenta esta afección en algún momento de sus vidas.... Más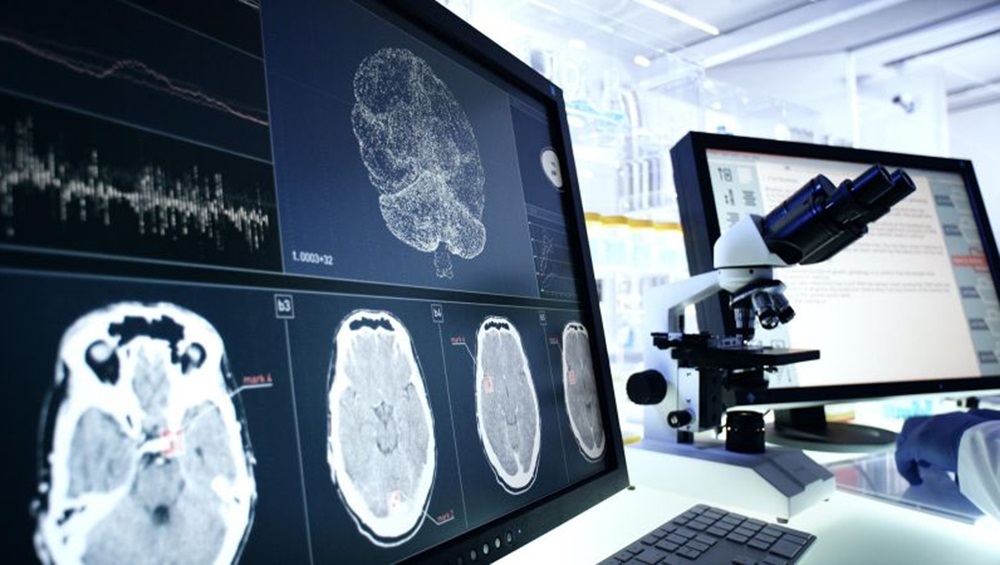
Prueba simple de biopsia de piel detecta el Parkinson y enfermedades neurodegenerativas relacionadas
La enfermedad de Parkinson y un grupo de trastornos neurodegenerativos relacionados conocidos como sinucleinopatías afectan a millones de personas en todo el mundo. Estas afecciones, incluida la... MásTecnología
ver canal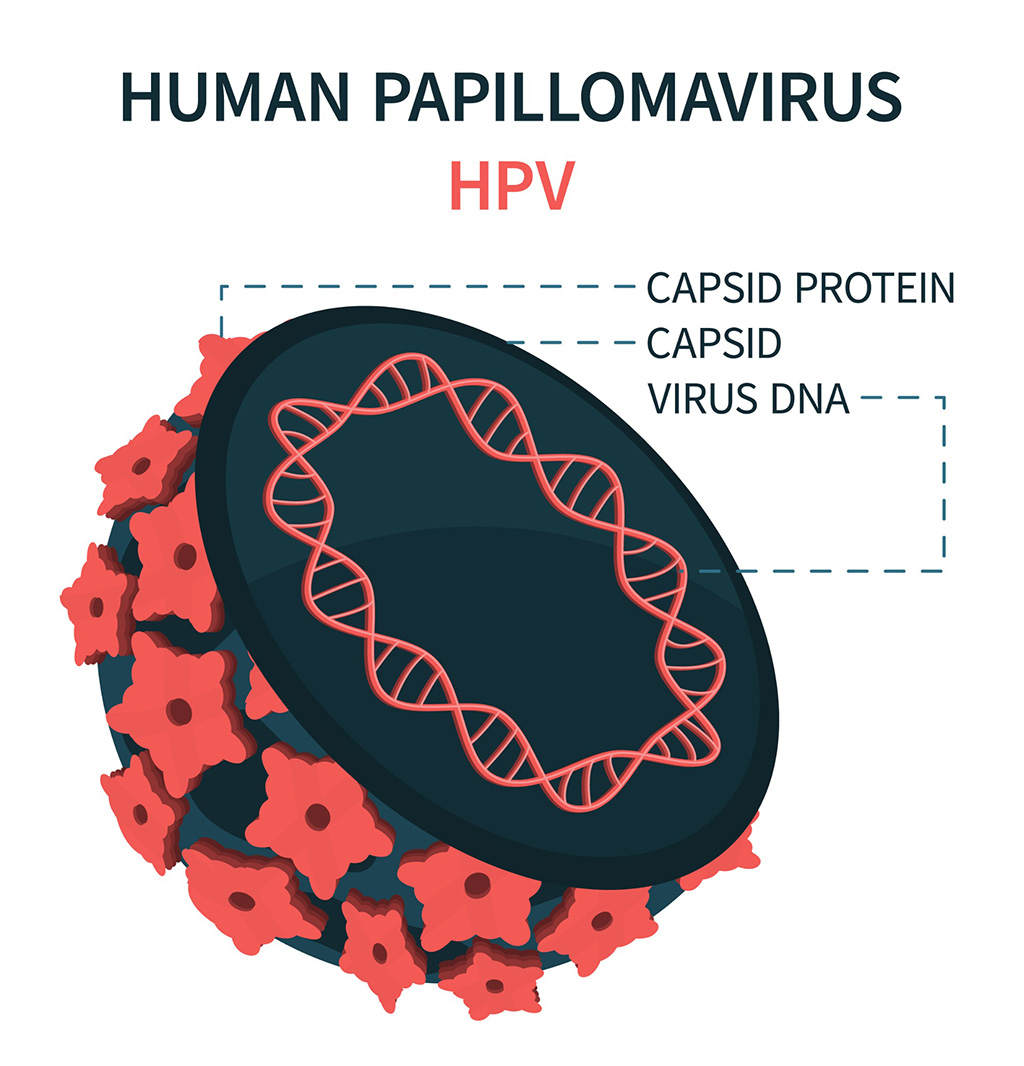
Biosensor de ADN permite diagnóstico temprano del cáncer de cuello uterino
El disulfuro de molibdeno (MoS2), reconocido por su potencial para formar nanoláminas bidimensionales como el grafeno, es un material que llama cada vez más la atención de la comunidad... Más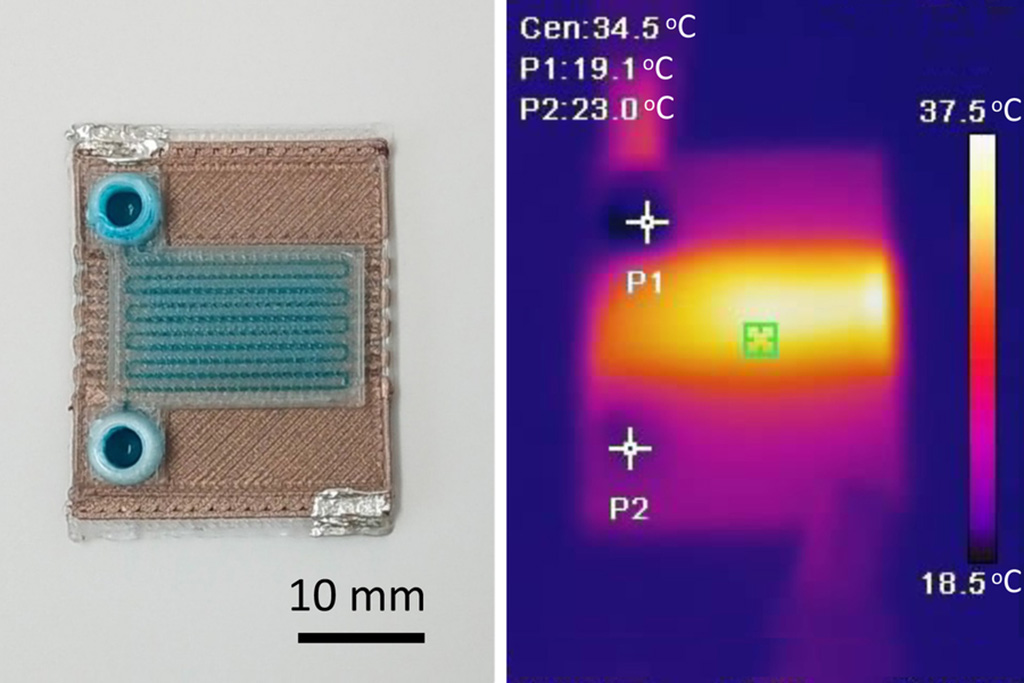
Dispositivos de microfluidos autocalentables pueden detectar enfermedades en pequeñas muestras de sangre o fluidos
Los microfluidos, que son dispositivos en miniatura que controlan el flujo de líquidos y facilitan reacciones químicas, desempeñan un papel clave en la detección de enfermedades... Más
Avance en tecnología de diagnóstico podría hacer que pruebas en el sitio sean ampliamente accesibles
Las pruebas caseras adquirieron una importancia significativa durante la pandemia de COVID-19, sin embargo, la disponibilidad de pruebas rápidas es limitada y la mayoría de ellas solo pueden conducir un... MásIndustria
ver canal
Congreso ECCMID cambia de nombre a ESCMID Global
En los últimos años, la Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas (ESCMID, Basilea, Suiza) ha evolucionado notablemente. La sociedad es ahora más... Más













.jpg)
.jpg)