Primera prueba molecular aprobada por la FDA para detectar malaria en donantes de sangre podría mejorar seguridad del paciente
|
Por el equipo editorial de LabMedica en español Actualizado el 25 Apr 2024 |
La malaria, una enfermedad grave que a menudo provoca la muerte, se transmite por una especie específica de mosquito que infecta a los humanos con un parásito. Otros modos de transmisión incluyen transfusiones de sangre, trasplantes de órganos y agujas o jeringas compartidas contaminadas con sangre infectada. Aunque la mayor carga de malaria se encuentra en el África subsahariana, el sudeste asiático, el Mediterráneo oriental, el Pacífico occidental y las Américas también reportan muchos casos y muertes. Debido al riesgo de transmisión de malaria, muchos posibles donantes de sangre que han viajado o vivido en áreas endémicas de malaria actualmente no son elegibles para donar sangre. Los métodos existentes para detectar la malaria en sangre, como la microscopía y la serología, carecen de la sensibilidad necesaria para garantizar la seguridad de las transfusiones de sangre. Ahora, la primera prueba molecular aprobada por la FDA para detectar malaria en donantes de sangre estadounidenses marca un avance significativo en el mantenimiento de un suministro mundial de sangre seguro.
Roche (Basilea, Suiza) ha obtenido la aprobación de la FDA para la prueba cobas Malaria para su uso en los sistemas cobas 6800/8800. Esta prueba permite a los proveedores de atención médica minimizar los riesgos de transmisión de malaria a través de transfusiones de sangre al identificar unidades de sangre infectadas con malaria. Detecta las cinco especies principales de parásitos Plasmodium que causan malaria en humanos, mejorando tanto la seguridad como la disponibilidad de los suministros de sangre. Diseñada para detectar donaciones de sangre, órganos y tejidos, la prueba cobas Malaria es una prueba cualitativa in vitro que detecta el ARN y el ADN de Plasmodium en muestras de sangre completa de donantes individuales. Es fundamental tener en cuenta que la prueba no sirve para diagnosticar infecciones por Plasmodium, ni es aplicable a muestras de sangre de cordón umbilical o muestras de sangre de cadáveres. Al utilizar el tubo de extracción de sangre completa de Roche, la prueba agiliza el flujo de trabajo al permitir la extracción directa de sangre de los donantes y el procesamiento inmediato en los sistemas cobas 6800/8800.
"Al ser la primera prueba de detección de malaria en sangre aprobada por la FDA, representa un importante paso adelante para salvaguardar el suministro mundial de sangre donada", afirmó Matt Sause, director ejecutivo de Roche Diagnostics. "La aprobación de cobas Malaria representa un avance significativo en la detección de la malaria, ofreciendo a los profesionales de la salud una herramienta confiable para la detección de donantes y mejorando la seguridad de los pacientes en todo el mundo”.
Últimas Diagnóstico Molecular noticias
- Prueba de hisopado oral POC para aumenta posibilidades de embarazo en la FIV
- Prueba de ADN microbiano libre de células identifica patógenos de neumonía y otras infecciones pulmonares
- Método sin biopsia transforma diagnóstico de enfermedad celíaca en adultos
- Innovadora prueba de diagnóstico molecular señala con precisión principal causa genética de EPOC
- Prueba diagnóstica de sangre detecta espondiloartritis axial
- Nueva etiqueta molecular desarrolla pruebas de tuberculosis más sencillas y rápidas
- Descubrimiento de biomarcador abre camino para que análisis de sangre detecten y traten osteoartritis
- Prueba de biopsia líquida detecta recurrencia en pacientes con CCR antes de las imágenes
- Prueba ultrarrápida de líquido sinovial diagnostica osteoartritis y artritis reumatoide en 10 minutos
- Herramienta genética predice supervivencia de pacientes con cáncer de páncreas
- Prueba de orina diagnostica cáncer de próstata inicial
- Nueva herramienta genética analiza sangre del cordón umbilical para predecir enfermedades
- Biomarcador del líquido cefalorraquídeo para enfermedad de Parkinson ofrece diagnóstico temprano y preciso
- Revolucionaria prueba detecta 30 tipos diferentes de cáncer con 98 % de precisión
- Simple análisis de sangre predice mejor riesgo de enfermedad cardíaca
- Nuevo análisis de sangre detecta 12 cánceres antes de que aparezcan síntomas
Canales
Química Clínica
ver canal
Análisis de sangre con IA detecta cáncer de ovario
El cáncer de ovario se ubica como la quinta causa principal de muerte por cáncer en mujeres, debido principalmente a diagnósticos en etapas tardías. Si bien más del 90... Más
Ensayo automatizado y descentralizado de NGS de ADNlc identifica alteraciones en tumores sólidos avanzados
Los análisis actuales de ADN libre circulante (ADNlc) suelen estar centralizados, lo que requiere un manejo y transporte especializados de las muestras. La introducción de un sistema de secuenciación flexible... MásHematología
ver canal
Primera prueba de monitorización de heparina POC proporciona resultados rápidos
La dosificación de heparina requiere un manejo cuidadoso para evitar complicaciones hemorrágicas y de coagulación. En situaciones de alto riesgo, como la oxigenación por membrana... Más
Nuevo sistema de puntuación predice riesgo de cáncer a partir de un trastorno sanguíneo común
La citopenia clonal de significado incierto (CCSI) es un trastorno sanguíneo común en adultos mayores, caracterizado por mutaciones en las células sanguíneas y un recuento ... MásInmunología
ver canal
Prueba de células madre predice resultado del tratamiento en cáncer de ovario resistente al platino
El cáncer de ovario epitelial suele responder inicialmente a la quimioterapia, pero con el tiempo, el tumor desarrolla resistencia a la terapia, lo que provoca su recrecimiento. Esta resistencia... Más
Análisis de sangre con aprendizaje automático predice respuesta a inmunoterapia en pacientes con linfoma
La terapia de células T con receptores de antígenos quiméricos (CAR) se ha convertido en uno de los avances recientes más prometedores en el tratamiento de los cánceres... MásMicrobiología
ver canal
Nuevo análisis de sangre detecta hasta cinco enfermedades infecciosas en punto de atención
Los investigadores han desarrollado un prototipo de ensayo de flujo continuo capaz de detectar hasta cinco infecciones diferentes, cuyos resultados pueden analizarse y transmitirse rápidamente mediante... Más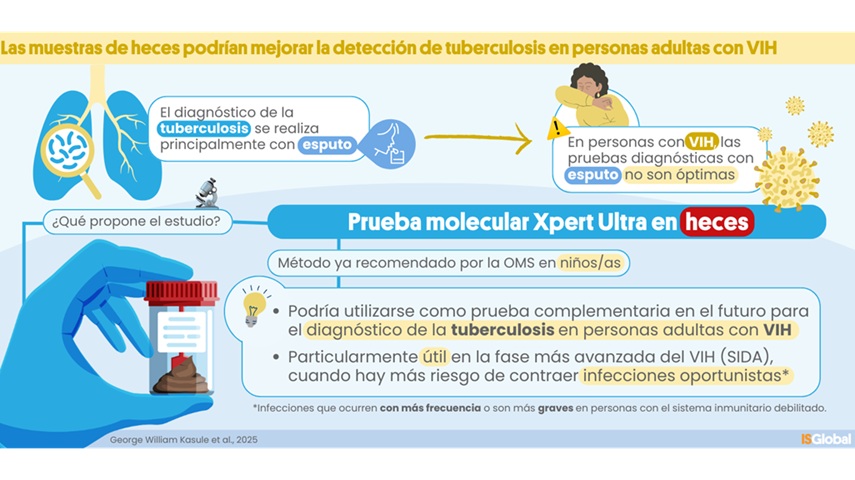
Prueba molecular de heces muestra potencial para diagnosticar tuberculosis en adultos con VIH
La tuberculosis (TB), causada por la bacteria Mycobacterium tuberculosis, provocó 1,25 millones de muertes en 2023, de las cuales el 13 % se produjeron en personas con VIH. El principal método... MásPatología
ver canal
Innovador algoritmo de triaje del dolor torácico transforma la atención cardíaca
Las enfermedades cardiovasculares son responsables de un tercio de las muertes en todo el mundo, y el dolor torácico es la segunda causa más común de visitas a urgencias.... Más
Enfoque de biopsia líquida basado en IA revolucionará detección del cáncer cerebral
Detectar cánceres cerebrales sigue siendo extremadamente difícil, ya que muchos pacientes solo reciben un diagnóstico en etapas avanzadas, tras la aparición de síntomas... MásTecnología
ver canal
Algoritmos predictivos avanzados identifican pacientes con cáncer no diagnosticado
Dos algoritmos predictivos avanzados recientemente desarrollados aprovechan el estado de salud de una persona y los resultados de análisis de sangre básicos para predecir con precisión... Más
Algoritmo de firma de luz permite diagnósticos médicos más rápidos y precisos
Cada material o molécula interactúa con la luz de forma única, creando un patrón distintivo, similar a una huella dactilar. La espectroscopia óptica, que consiste en... MásIndustria
ver canal
Qiagen adquiere Genoox, empresa de software de análisis NGS
QIAGEN (Venlo, Países Bajos) ha firmado un acuerdo definitivo para adquirir Genoox (Tel Aviv, Israel), un proveedor de software impulsado por inteligencia artificial (IA) que permite a los laboratorios... Más