Número de copias genómicas predice el cáncer de esófago años antes de la transformación
|
Por el equipo editorial de LabMedica en español Actualizado el 21 Sep 2020 |
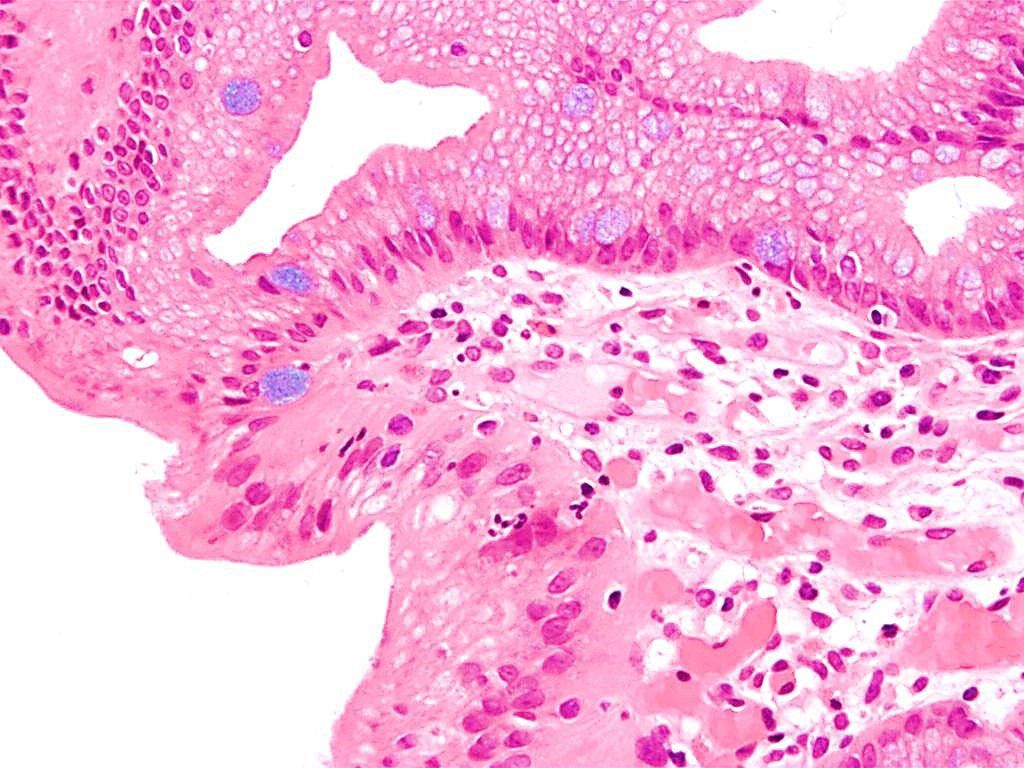
Imagen: Microfotografía de la histopatología del esófago de Barrett que muestra las células características caliciformes (coloración de azul de Alciano) (Fotografía cortesía de Nephron)
El esófago de Barrett es una afección en la que cambia el revestimiento del esófago y se parece más al revestimiento del intestino delgado que al del esófago. Esto ocurre en el área donde el esófago se une al estómago.
La mayoría de los pacientes con esófago de Barrett no desarrollarán cáncer. En algunos pacientes, sin embargo, se desarrollará un cambio precanceroso en el tejido, llamado displasia. Es más probable que ese cambio precanceroso se convierta en cáncer de esófago.
Un equipo de científicos de la Universidad de Cambridge (Cambridge, Reino Unido) evaluó si estas señales genómicas se pueden utilizar para la detección temprana y el tratamiento preventivo del cáncer utilizando la lesión precursora neoplásica del esófago de Barrett como ejemplo. Llevaron a cabo una secuenciación superficial del genoma completo en una cohorte retrospectiva de casos y controles de 88 pacientes. Se recolectaron más de 770 muestras de endoscopia de los pacientes durante la vigilancia clínica del esófago de Barrett. El equipo utilizó una secuenciación superficial del genoma completo, ya que no solo ofrecía una visión general de los cambios en el número de copias, sino que también se había optimizado para su uso en muestras fijadas con formol e incluidas en parafina.
En general, encontraron que las muestras de pacientes cuya enfermedad progresó hasta convertirse en cáncer presentaban un trastorno generalizado en sus genomas. Sobre la base de los datos del número de copias que generaron y una medida de la complejidad general, el equipo desarrolló un modelo de regresión logística regularizada por red elástica de progresión y clasificación de la enfermedad. Validaron el modelo en una cohorte independiente de 76 pacientes y lo validaron ortogonalmente a través de muestras de matriz de polimorfismo de nucleótido único (SNP) de 248 pacientes. Algo más de la mitad de las muestras (55%) de pacientes que no progresaron se clasificaron como de bajo riesgo utilizando el modelo del investigador. Al mismo tiempo, el 77% de las muestras de pacientes que progresaron se clasificaron como de alto riesgo.
Cuando se analizó junto con las pautas actuales de manejo del esófago de Barrett, los científicos estimaron que su enfoque habría llevado al 54% de los pacientes que progresaron a recibir un tratamiento más temprano. Mientras tanto, también estimaron que de los pacientes que no progresaron, en el 51% se habrían hecho endoscopias menos frecuentes si se hubiera aplicado su modelo.
Rebecca C. Fitzgerald, MD, FMedSci, profesora de prevención del cáncer y autora principal del estudio, dijo: “Esto demuestra que la estratificación del riesgo genómico tiene un potencial realista para permitir una intervención más temprana para las condiciones de alto riesgo y al mismo tiempo reducir la intensidad del seguimiento e incluso reducir el sobretratamiento en casos de enfermedad estable”.
Los autores concluyeron que sus métodos son de bajo costo y aplicables a muestras de biopsia clínica estándar. En comparación con las pautas de tratamiento actuales basadas en la histopatología y la presentación clínica, la clasificación genómica permite un tratamiento más temprano para los pacientes de alto riesgo, así como la reducción del tratamiento innecesario y la monitorización para los pacientes que tienen pocas probabilidades de desarrollar cáncer. El estudio fue publicado el 7 de septiembre de 2020 en la revista Nature Medicine.
Enlace relacionado:
Universidad de Cambridge
La mayoría de los pacientes con esófago de Barrett no desarrollarán cáncer. En algunos pacientes, sin embargo, se desarrollará un cambio precanceroso en el tejido, llamado displasia. Es más probable que ese cambio precanceroso se convierta en cáncer de esófago.
Un equipo de científicos de la Universidad de Cambridge (Cambridge, Reino Unido) evaluó si estas señales genómicas se pueden utilizar para la detección temprana y el tratamiento preventivo del cáncer utilizando la lesión precursora neoplásica del esófago de Barrett como ejemplo. Llevaron a cabo una secuenciación superficial del genoma completo en una cohorte retrospectiva de casos y controles de 88 pacientes. Se recolectaron más de 770 muestras de endoscopia de los pacientes durante la vigilancia clínica del esófago de Barrett. El equipo utilizó una secuenciación superficial del genoma completo, ya que no solo ofrecía una visión general de los cambios en el número de copias, sino que también se había optimizado para su uso en muestras fijadas con formol e incluidas en parafina.
En general, encontraron que las muestras de pacientes cuya enfermedad progresó hasta convertirse en cáncer presentaban un trastorno generalizado en sus genomas. Sobre la base de los datos del número de copias que generaron y una medida de la complejidad general, el equipo desarrolló un modelo de regresión logística regularizada por red elástica de progresión y clasificación de la enfermedad. Validaron el modelo en una cohorte independiente de 76 pacientes y lo validaron ortogonalmente a través de muestras de matriz de polimorfismo de nucleótido único (SNP) de 248 pacientes. Algo más de la mitad de las muestras (55%) de pacientes que no progresaron se clasificaron como de bajo riesgo utilizando el modelo del investigador. Al mismo tiempo, el 77% de las muestras de pacientes que progresaron se clasificaron como de alto riesgo.
Cuando se analizó junto con las pautas actuales de manejo del esófago de Barrett, los científicos estimaron que su enfoque habría llevado al 54% de los pacientes que progresaron a recibir un tratamiento más temprano. Mientras tanto, también estimaron que de los pacientes que no progresaron, en el 51% se habrían hecho endoscopias menos frecuentes si se hubiera aplicado su modelo.
Rebecca C. Fitzgerald, MD, FMedSci, profesora de prevención del cáncer y autora principal del estudio, dijo: “Esto demuestra que la estratificación del riesgo genómico tiene un potencial realista para permitir una intervención más temprana para las condiciones de alto riesgo y al mismo tiempo reducir la intensidad del seguimiento e incluso reducir el sobretratamiento en casos de enfermedad estable”.
Los autores concluyeron que sus métodos son de bajo costo y aplicables a muestras de biopsia clínica estándar. En comparación con las pautas de tratamiento actuales basadas en la histopatología y la presentación clínica, la clasificación genómica permite un tratamiento más temprano para los pacientes de alto riesgo, así como la reducción del tratamiento innecesario y la monitorización para los pacientes que tienen pocas probabilidades de desarrollar cáncer. El estudio fue publicado el 7 de septiembre de 2020 en la revista Nature Medicine.
Enlace relacionado:
Universidad de Cambridge
Últimas Patología noticias
- Innovador algoritmo de triaje del dolor torácico transforma la atención cardíaca
- Enfoque de biopsia líquida basado en IA revolucionará detección del cáncer cerebral
- Análisis de imágenes de patología digital con IA mejora subtipificación del sarcoma pediátrico
- Modelo de IA predice respuesta a terapia contra cáncer de riñón
- Kits de ensayo de enzima DUB sensibles y específicos requieren configuración mínima sin preparación del sustrato
- Primer modelo de IA para diagnóstico de cáncer de tiroides con precisión superior al 90 %
- Enfoque diagnóstico innovador mejora significativamente la detección de tuberculosis
- Método de detección rápido, ultrasensible y sin PCR hace el análisis genético más accesible
- Prueba de saliva más precisa para identificar riesgo de cáncer de próstata
- Nanotecnología del ADN aumenta sensibilidad de tiras reactivas
- Nuevo método basado en aprendizaje automático detecta contaminación microbiana en cultivos celulares
- Nuevo método con corrección de errores detecta cáncer únicamente en muestras de sangre
- Algoritmo "detector de metales" consigue tumores vulnerables
- Nueva técnica identifica y clasifica subtipos de células de cáncer de páncreas
- Imágenes avanzadas revelan mecanismos que causan enfermedades autoinmunes
- Modelo de IA predice eficazmente resultados de pacientes con cáncer de pulmón
Canales
Química Clínica
ver canal
Análisis de sangre con IA detecta cáncer de ovario
El cáncer de ovario se ubica como la quinta causa principal de muerte por cáncer en mujeres, debido principalmente a diagnósticos en etapas tardías. Si bien más del 90... Más
Ensayo automatizado y descentralizado de NGS deADNlc identifica alteraciones en tumores sólidos avanzados
Los análisis actuales de ADN libre circulante (ADNlc) suelen estar centralizados, lo que requiere un manejo y transporte especializados de las muestras. La introducción de un sistema de ... MásHematología
ver canal
Primera prueba de monitorización de heparina POC proporciona resultados rápidos
La dosificación de heparina requiere un manejo cuidadoso para evitar complicaciones hemorrágicas y de coagulación. En situaciones de alto riesgo, como la oxigenación por membrana... Más
Nuevo sistema de puntuación predice riesgo de cáncer a partir de un trastorno sanguíneo común
La citopenia clonal de significado incierto (CCSI) es un trastorno sanguíneo común en adultos mayores, caracterizado por mutaciones en las células sanguíneas y un recuento ... MásInmunología
ver canal
Prueba de células madre predice resultado del tratamiento en cáncer de ovario resistente al platino
El cáncer de ovario epitelial suele responder inicialmente a la quimioterapia, pero con el tiempo, el tumor desarrolla resistencia a la terapia, lo que provoca su recrecimiento. Esta resistencia... Más
Análisis de sangre con aprendizaje automático predice respuesta a inmunoterapia en pacientes con linfoma
La terapia de células T con receptores de antígenos quiméricos (CAR) se ha convertido en uno de los avances recientes más prometedores en el tratamiento de los cánceres... MásMicrobiología
ver canal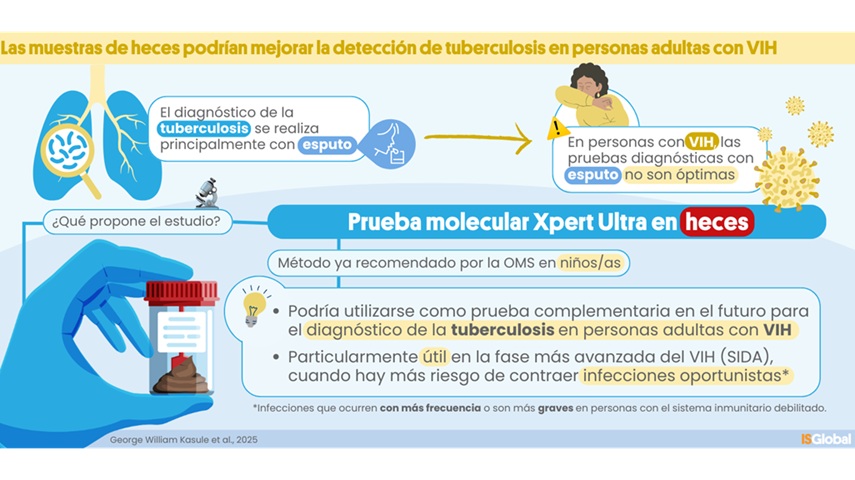
Prueba molecular de heces muestra potencial para diagnosticar tuberculosis en adultos con VIH
La tuberculosis (TB), causada por la bacteria Mycobacterium tuberculosis, provocó 1,25 millones de muertes en 2023, de las cuales el 13 % se produjeron en personas con VIH. El principal método... Más
Nueva prueba diagnostica meningitis bacteriana con rapidez y precisión
La meningitis bacteriana es una afección potencialmente mortal: uno de cada seis pacientes fallece y la mitad de los supervivientes experimentan síntomas persistentes. Por lo tanto, un d... MásPatología
ver canal
Innovador algoritmo de triaje del dolor torácico transforma la atención cardíaca
Las enfermedades cardiovasculares son responsables de un tercio de las muertes en todo el mundo, y el dolor torácico es la segunda causa más común de visitas a urgencias.... Más
Enfoque de biopsia líquida basado en IA revolucionará detección del cáncer cerebral
Detectar cánceres cerebrales sigue siendo extremadamente difícil, ya que muchos pacientes solo reciben un diagnóstico en etapas avanzadas, tras la aparición de síntomas... MásTecnología
ver canal
Algoritmos predictivos avanzados identifican pacientes con cáncer no diagnosticado
Dos algoritmos predictivos avanzados recientemente desarrollados aprovechan el estado de salud de una persona y los resultados de análisis de sangre básicos para predecir con precisión... Más
Algoritmo de firma de luz permite diagnósticos médicos más rápidos y precisos
Cada material o molécula interactúa con la luz de forma única, creando un patrón distintivo, similar a una huella dactilar. La espectroscopia óptica, que consiste en... MásIndustria
ver canal
Cepheid y Oxford Nanopore se unen para desarrollar soluciones con secuenciación automatizada
Cepheid (Sunnyvale, CA, EUA), una empresa líder en diagnóstico molecular, y Oxford Nanopore Technologies (Oxford, Reino Unido), la empresa detrás de una nueva generación de... Más