Pfizer y BioNTech aseguran la primera autorización mundial para una vacuna contra la COVID-19
|
Por el equipo editorial de LabMedica en español Actualizado el 04 Dec 2020 |

Ilustración
Pfizer Inc. (Nueva York, NY, EUA) y Biopharmaceutical New Technologies (BioNTech, Maguncia, Alemania) recibieron una autorización temporal de la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) en el Reino Unido para uso de emergencia de su vacuna, hecha con ARNm de COVID-19 (BNT162b2), contra la COVID-19.
Esta constituye la primera autorización de uso de emergencia después de un ensayo mundial de fase 3 de una vacuna para ayudar a combatir la pandemia. La decisión de la MHRA se basa en una presentación continua, que incluye datos del estudio clínico de Fase 3, que demostró una tasa de eficacia de la vacuna del 95% (p <0,0001) en participantes sin infección previa por SARS-CoV-2 (primer objetivo principal) y también en participantes con y sin infección previa por SARS-CoV-2 (segundo objetivo primario), en cada caso medido a partir de 7 días después de la segunda dosis. El primer análisis del objetivo principal se basa en 170 casos de COVID-19, como se especifica en el protocolo del estudio. La eficacia fue constante en todos los datos demográficos de edad, sexo, raza y etnia, con una eficacia observada en adultos de 65 años o más de más del 94%. En el ensayo, BNT162b2 fue generalmente bien tolerado y hasta la fecha el Comité de Monitoreo de Datos no informó de problemas graves de seguridad. La decisión también se basó en una revisión de los datos de Química, Fabricación y Control (CMC) de Pfizer y BioNTech para BNT162b2.
Ahora que la vacuna está autorizada en el Reino Unido, las empresas tomarán medidas inmediatas para comenzar a administrar las dosis de la vacuna. En julio de 2020, Pfizer y BioNTech habían anunciado un acuerdo con el Reino Unido para suministrar 30 millones de dosis de la vacuna basada en ARNm, BNT162b2, una vez autorizada para uso de emergencia. Ese acuerdo se incrementó a 40 millones de dosis a principios de octubre. La entrega de los 40 millones de dosis se producirá a lo largo de 2020 y 2021, por etapas, para garantizar una asignación equitativa de vacunas en las geografías con contratos ejecutados. La distribución de la vacuna en el Reino Unido se priorizará de acuerdo con las poblaciones identificadas en las orientaciones del Comité Conjunto de Vacunación e Inmunización (JCVI). Se espera que las primeras dosis lleguen al Reino Unido en los próximos días y que la entrega se complete en 2021.
Pfizer y BioNTech anticipan nuevas decisiones regulatorias en todo el mundo en los próximos días y semanas y están listos para administrar dosis de vacunas tras posibles autorizaciones o aprobaciones regulatorias. Las empresas han presentado una solicitud de Autorización de Uso en Emergencias ante la Administración de Alimentos y Medicamentos de los EUA (FDA) y presentaron la Solicitud de Autorización de Comercialización Condicional (CA) final luego de presentaciones sucesivas ante la Agencia Europea de Medicamentos (EMA) y varias otras agencias reguladoras alrededor del mundo.
“La autorización de uso de emergencia de hoy en el Reino Unido marca un momento histórico en la lucha contra la COVID-19. Esta autorización es un objetivo por el que hemos trabajado desde que declaramos por primera vez que la ciencia ganará y aplaudimos a la MHRA por su capacidad para realizar una evaluación cuidadosa y tomar medidas oportunas para ayudar a proteger a la gente del Reino Unido”, dijo Albert Bourla, presidente y director ejecutivo de Pfizer. “A medida que anticipamos más autorizaciones y aprobaciones, nos enfocamos en avanzar con el mismo nivel de urgencia para suministrar de manera segura una vacuna de alta calidad en todo el mundo. Con miles de personas infectadas, todos los días son importantes en la carrera colectiva para poner fin a esta devastadora pandemia”.
“La Autorización de Uso de Emergencia en el Reino Unido marcará la primera vez que los ciudadanos, que se encuentran fuera de los ensayos, tengan la oportunidad de ser inmunizados contra la COVID-19”, dijo Ugur Sahin, M.D., director ejecutivo y cofundador de BioNTech. “Creemos que la implementación del programa de vacunación en el Reino Unido reducirá el número de personas de la población de alto riesgo que serán hospitalizadas. Nuestro objetivo es llevar una vacuna segura y eficaz, tras su aprobación, a las personas que la necesitan. Los datos enviados a las agencias reguladoras de todo el mundo son el resultado de un programa de investigación y desarrollo científicamente riguroso y altamente ético”.
Enlace relacionado:
Biopharmaceutical New Technologies
Esta constituye la primera autorización de uso de emergencia después de un ensayo mundial de fase 3 de una vacuna para ayudar a combatir la pandemia. La decisión de la MHRA se basa en una presentación continua, que incluye datos del estudio clínico de Fase 3, que demostró una tasa de eficacia de la vacuna del 95% (p <0,0001) en participantes sin infección previa por SARS-CoV-2 (primer objetivo principal) y también en participantes con y sin infección previa por SARS-CoV-2 (segundo objetivo primario), en cada caso medido a partir de 7 días después de la segunda dosis. El primer análisis del objetivo principal se basa en 170 casos de COVID-19, como se especifica en el protocolo del estudio. La eficacia fue constante en todos los datos demográficos de edad, sexo, raza y etnia, con una eficacia observada en adultos de 65 años o más de más del 94%. En el ensayo, BNT162b2 fue generalmente bien tolerado y hasta la fecha el Comité de Monitoreo de Datos no informó de problemas graves de seguridad. La decisión también se basó en una revisión de los datos de Química, Fabricación y Control (CMC) de Pfizer y BioNTech para BNT162b2.
Ahora que la vacuna está autorizada en el Reino Unido, las empresas tomarán medidas inmediatas para comenzar a administrar las dosis de la vacuna. En julio de 2020, Pfizer y BioNTech habían anunciado un acuerdo con el Reino Unido para suministrar 30 millones de dosis de la vacuna basada en ARNm, BNT162b2, una vez autorizada para uso de emergencia. Ese acuerdo se incrementó a 40 millones de dosis a principios de octubre. La entrega de los 40 millones de dosis se producirá a lo largo de 2020 y 2021, por etapas, para garantizar una asignación equitativa de vacunas en las geografías con contratos ejecutados. La distribución de la vacuna en el Reino Unido se priorizará de acuerdo con las poblaciones identificadas en las orientaciones del Comité Conjunto de Vacunación e Inmunización (JCVI). Se espera que las primeras dosis lleguen al Reino Unido en los próximos días y que la entrega se complete en 2021.
Pfizer y BioNTech anticipan nuevas decisiones regulatorias en todo el mundo en los próximos días y semanas y están listos para administrar dosis de vacunas tras posibles autorizaciones o aprobaciones regulatorias. Las empresas han presentado una solicitud de Autorización de Uso en Emergencias ante la Administración de Alimentos y Medicamentos de los EUA (FDA) y presentaron la Solicitud de Autorización de Comercialización Condicional (CA) final luego de presentaciones sucesivas ante la Agencia Europea de Medicamentos (EMA) y varias otras agencias reguladoras alrededor del mundo.
“La autorización de uso de emergencia de hoy en el Reino Unido marca un momento histórico en la lucha contra la COVID-19. Esta autorización es un objetivo por el que hemos trabajado desde que declaramos por primera vez que la ciencia ganará y aplaudimos a la MHRA por su capacidad para realizar una evaluación cuidadosa y tomar medidas oportunas para ayudar a proteger a la gente del Reino Unido”, dijo Albert Bourla, presidente y director ejecutivo de Pfizer. “A medida que anticipamos más autorizaciones y aprobaciones, nos enfocamos en avanzar con el mismo nivel de urgencia para suministrar de manera segura una vacuna de alta calidad en todo el mundo. Con miles de personas infectadas, todos los días son importantes en la carrera colectiva para poner fin a esta devastadora pandemia”.
“La Autorización de Uso de Emergencia en el Reino Unido marcará la primera vez que los ciudadanos, que se encuentran fuera de los ensayos, tengan la oportunidad de ser inmunizados contra la COVID-19”, dijo Ugur Sahin, M.D., director ejecutivo y cofundador de BioNTech. “Creemos que la implementación del programa de vacunación en el Reino Unido reducirá el número de personas de la población de alto riesgo que serán hospitalizadas. Nuestro objetivo es llevar una vacuna segura y eficaz, tras su aprobación, a las personas que la necesitan. Los datos enviados a las agencias reguladoras de todo el mundo son el resultado de un programa de investigación y desarrollo científicamente riguroso y altamente ético”.
Enlace relacionado:
Biopharmaceutical New Technologies
Últimas COVID-19 noticias
- Inmunosensor nuevo allana el camino para pruebas rápidas POC para COVID-19 y enfermedades infecciosas emergentes
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Prueba nueva COVID + Influenza + VSR ayudará a estar preparados para la ‘tripledemia’
- IA elimina las conjeturas de las pruebas de flujo lateral
- Prueba de antígeno del SARS-CoV-2 más rápida, jamás diseñada, permite realizar pruebas de COVID-19 no invasivas en cualquier entorno
- Pruebas rápidas de antígeno detectan las variantes ómicron, delta del SARS-CoV-2
- Prueba en sangre realizada durante la infección inicial predice el riesgo de COVID prolongada
- Investigadores afirman que hay que crear “reservistas” de laboratorio para responder más rápidamente a la próxima pandemia
- Estudio encuentra que los profesionales sanitarios mostraron mayor interés en tecnologías POC durante la pandemia
- Plataforma de análisis de bajo costo para la COVID-19 combina sensibilidad de la PCR y velocidad de pruebas de antígeno
- Prueba de sangre por punción digital identifica inmunidad a la COVID-19
- Kit de prueba rápida determina inmunidad contra la COVID-19 y sus variantes
Canales
Química Clínica
ver canal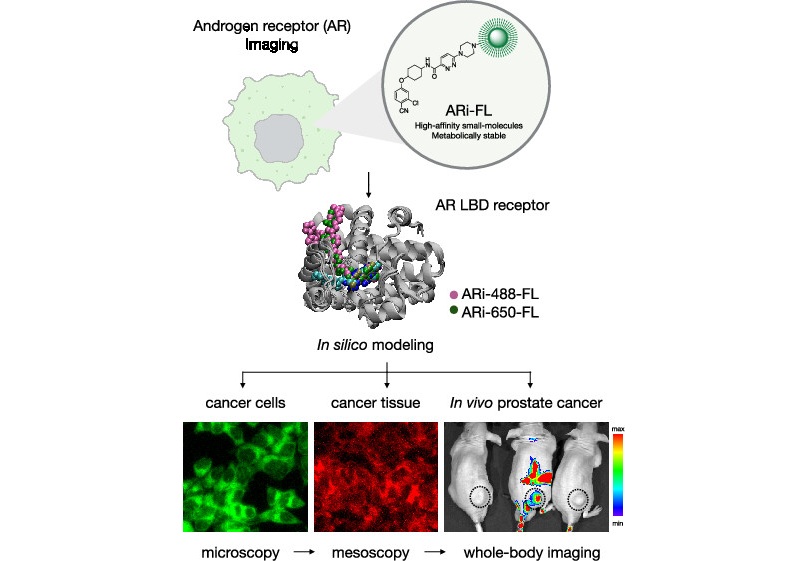
Sonda de imágenes químicas podría rastrear y tratar cáncer de próstata
El cáncer de próstata sigue siendo una de las principales causas de enfermedad y muerte en hombres, y muchos pacientes desarrollan resistencia a las terapias hormonales bloqueantes convencionales.... Más
Discrepancia entre dos pruebas comunes de función renal indica problemas de salud graves
La creatinina ha sido durante mucho tiempo el método estándar para medir la filtración renal, mientras que la cistatina C, una proteína producida por todas las células humanas, se ha recomendado como marcador... MásDiagnóstico Molecular
ver canal
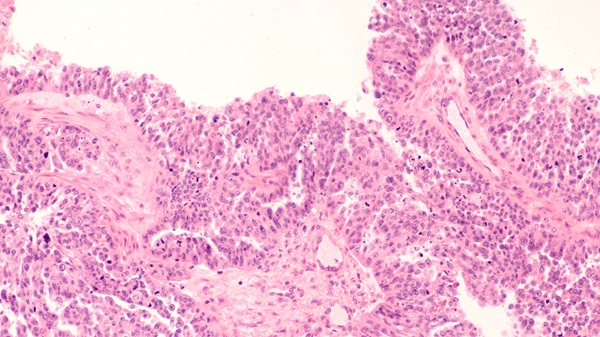
Sencilla prueba de orina revolucionará diagnóstico y tratamiento del cáncer de vejiga
El cáncer de vejiga es uno de los cánceres urológicos más comunes y mortales, y se caracteriza por una alta tasa de recurrencia. El diagnóstico y el seguimiento aún... Más
Análisis snaguíneo para detección más temprana y sencilla de fibrosis hepática
El daño hepático persistente causado por el abuso de alcohol o infecciones virales puede desencadenar fibrosis hepática, una afección en la que el tejido sano se reemplaza gradualmente... MásHematología
ver canal
Análisis sanguíneo de actividad plaquetaria en mediana edad podría identificar riesgo temprano de Alzheimer
La detección temprana de la enfermedad de Alzheimer sigue siendo una de las mayores necesidades insatisfechas en neurología, sobre todo porque los cambios biológicos que subyacen al... Más
Medición de microvesículas podría detectar lesiones vasculares en pacientes con anemia falciforme
Evaluar la gravedad de la enfermedad de células falciformes (ECF) sigue siendo un reto, sobre todo al intentar predecir la hemólisis, el daño vascular y el riesgo de complicaciones... MásInmunología
ver canal
Nueva prueba distingue falsos positivos inducidos por vacuna de infección activa por VIH
Desde que se identificó el VIH en 1983, más de 91 millones de personas han contraído el virus y más de 44 millones han fallecido por causas relacionadas. Hoy en día, casi 40 millones de personas en todo... Más
Prueba de firma genética predice respuesta a tratamientos clave para cáncer de mama
Los inhibidores de DK4/6, combinados con terapia hormonal, se han convertido en un tratamiento fundamental para el cáncer de mama avanzado HR+/HER2–, ya que ralentizan el crecimiento tumoral... MásMicrobiología
ver canal
Prueba de diagnóstico rápido es estándar de oro para detección de sepsis
La sepsis causa la muerte de 11 millones de personas en todo el mundo cada año y genera enormes costos de atención médica. Solo en EUA y Europa, la sepsis representa 100.... MásPrueba rápida de tuberculosis POC proporciona resultados en 15 minutos
La tuberculosis sigue siendo una de las enfermedades infecciosas más mortales del mundo, y la reducción de nuevos casos depende de la identificación de las personas con infección... MásPatología
ver canal
Dispositivo de clasificación celular sintonizable tiene potencial para aplicaciones biomédicas
Aislar células cancerosas raras de la sangre es esencial para diagnosticar metástasis y orientar las decisiones terapéuticas, pero sigue siendo un desafío técnico.... MásHerramienta de IA mejora a medicos detectando anomalías en células sanguíneas
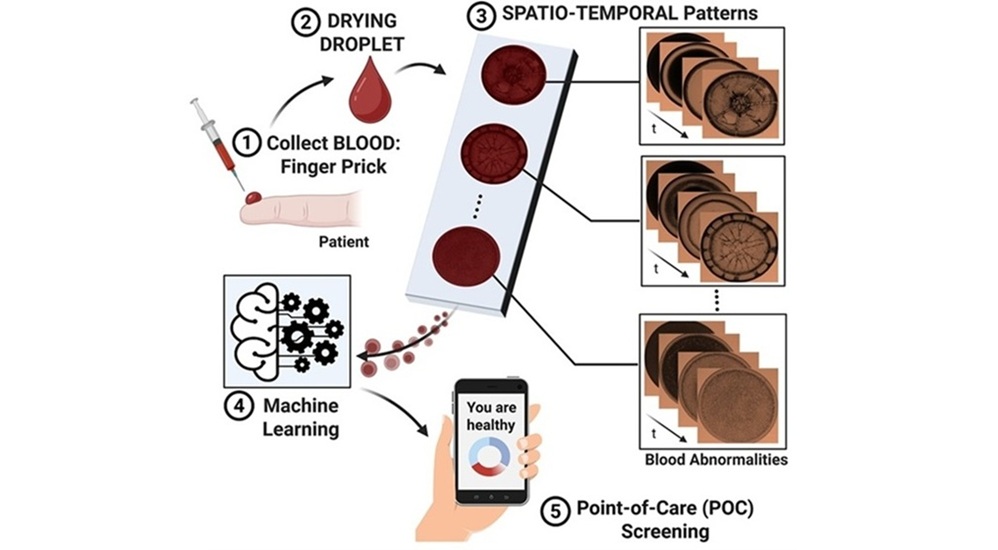
El diagnóstico de trastornos sanguíneos depende del reconocimiento de anomalías sutiles en el tamaño, la forma y la estructura celular. Sin embargo, este proceso es lento, subjetivo y requiere años de... Más
Herramienta de IA analiza rápidamente imágenes complejas de cáncer para tratamiento personalizado
Las imágenes complejas de biopsia digital, que normalmente requieren hasta 20 minutos para ser evaluadas por un patólogo experto, ahora pueden analizarse en aproximadamente un minuto mediante una nueva... MásTecnología
ver canal
Modelo de inteligencia artificial podría acelerar diagnóstico de enfermedades raras
Identificar qué variantes genéticas causan enfermedades sigue siendo uno de los mayores desafíos de la medicina genómica. Cada persona porta decenas de miles de cambios en el... Más
Sensor de saliva con IA permite detección precoz del cáncer de cabeza y cuello
La detección precoz del cáncer de cabeza y cuello sigue siendo difícil porque la enfermedad produce pocos o ningún síntoma en sus primeras etapas, y las lesiones a menudo... MásIndustria
ver canal
Abbott adquiere Exact Sciences, empresa de detección de cáncer
Abbott (Abbott Park, IL, EUA) ha firmado un acuerdo definitivo para adquirir Exact Sciences (Madison, WI, EUA), lo que le permitirá entrar y liderar en segmentos de diagnóstico de cáncer... Más