Ensayo rápido identifica patógenos de infecciones sanguíneas directamente en muestras de pacientes
Actualizado el 02 Dec 2025
Las infecciones del torrente sanguíneo en la sepsis progresan rápidamente y requieren un diagnóstico rápido y preciso. Los métodos actuales de hemocultivo suelen tardar de uno a cinco días en identificar el patógeno, lo que obliga a los médicos a tratar a ciegas con antibióticos de amplio espectro. Este retraso puede empeorar los resultados en una afección responsable de más de 1,7 millones de casos y más de 350.000 muertes al año en EUA. Un nuevo ensayo rápido de infecciones del torrente sanguíneo ofrece ahora respuestas a nivel de especie en dos horas, con el objetivo de acelerar la terapia antimicrobiana dirigida y reducir la mortalidad.
El ensayo SMART-ID BSI de Scanogen Inc. (Baltimore, MD, EUA) es una prueba rápida de molécula única que analiza sangre completa para identificar los patógenos que causan el 95 % de las infecciones del torrente sanguíneo en dos horas. El ensayo se basa en la tecnología SMART (Molécula Única y Anclaje Rápido), que aprovecha la detección de moléculas individuales para permitir la identificación directa de patógenos de infecciones del torrente sanguíneo en muestras de pacientes sin esperar el crecimiento del cultivo. La plataforma está diseñada para ofrecer una detección rápida, precisa y rentable, ideal para la toma de decisiones clínicas en tiempo real.
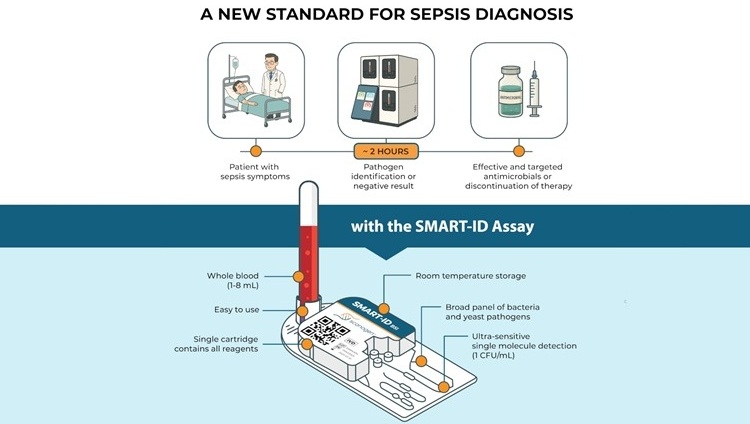
El ensayo insignia SMART-ID BSI de Scanogen ofrece una reducción drástica en el tiempo de diagnóstico de infecciones del torrente sanguíneo en pacientes con sepsis, en comparación con los métodos tradicionales de hemocultivo. El ensayo ofrece resultados de identificación a nivel de especie en tan solo dos horas, lo que supone una mejora considerable respecto a los entre uno y cinco días que suelen requerir los métodos actuales basados en hemocultivo.
La FDA de EUA ha otorgado la Designación de Dispositivo Innovador al ensayo rápido de la compañía, diseñado para identificar patógenos de infecciones del torrente sanguíneo directamente en muestras de pacientes. Esta designación reconoce el potencial del ensayo para mejorar el diagnóstico de una afección potencialmente mortal y permitir un desarrollo y una revisión regulatoria acelerados. La designación también refleja la capacidad de la tecnología para acortar el tiempo necesario para la terapia dirigida y contribuir a una mejor evolución de los pacientes.
Las implicaciones para la atención clínica son significativas. Se espera que la identificación oportuna de patógenos reduzca la dependencia de antibióticos de amplio espectro, disminuyendo el riesgo de resistencia y permitiendo un tratamiento guiado con precisión. Los hospitales también podrían beneficiarse de una menor duración de la hospitalización y de menores costos generales de atención, especialmente considerando que el manejo de la sepsis ya supera los 50.000 millones de dólares anuales en EUA. Scanogen planea acelerar el desarrollo del ensayo en el marco del programa Breakthrough y avanzar hacia la validación clínica y su posterior comercialización.
“Este reconocimiento de la FDA subraya la necesidad clínica de un diagnóstico de sepsis más rápido y preciso, y valida el impacto potencial de nuestra plataforma”, afirmó el Dr. Al Celedon, fundador y director ejecutivo de Scanogen. “Nuestro objetivo es empoderar a los profesionales clínicos con resultados prácticos en cuestión de horas, en lugar de días, porque cada hora cuenta en el tratamiento de la sepsis”.
Enlaces relacionados:
Scanogen Inc.