Nuevo proyecto de pautas para dispositivos de diagnóstico y radiología
|
Por el equipo editorial de LabMedica en español Actualizado el 24 Aug 2011 |
La Administración de Alimentos y Medicamentos de los EUA (Silver Spring, MD, EUA) ha disminuido los requisitos de notificación previa a la comercialización de determinados dispositivos de diagnóstico in vitro y de radiología con perfiles de seguridad y de eficacia bien establecidos.
El proyecto de pautas enumera 30 diferentes tipos de dispositivos, incluyendo análisis comunes de orina y de sangre, pruebas de alcoholemia, pruebas de proteínas coagulación de la sangre y accesorios para dispositivos de radiología, tales como cintas de película, procesadores de películas y digitalizadores. La FDA tiene la intención de eximir a estos dispositivos de los requisitos de notificación previa a la comercialización a través de los procesos de regulación pertinentes. En el ínterin, sin embargo, la FDA no tiene la intención de hacer cumplir los requisitos de notificación previa a la comercialización con respecto a estos dispositivos, siempre que no excedan los límites de exención especificados en los reglamentos de clasificación de dispositivos.
En el futuro, la FDA también tiene la intención de reducir la carga de regulación previa a la comercialización adicionalmente para los tipos de dispositivos de diagnóstico in vitro y de radiología.
“La seguridad y eficacia de estos dispositivos han sido bien demostradas a lo largo de los años”, dijo Jeffrey Shuren, MD, director del Centro para Dispositivos y Salud Radiológica de la FDA. “Al abordar el nivel de riesgo de estos dispositivos, la agencia está adoptando un método inteligente reglamentario que alivie de requisitos innecesarios a los fabricantes, mientras que se asegura de que el público tenga dispositivos seguros y efectivos”.
Los tipos de dispositivos enunciados en el proyecto de directrices incluyen dispositivos identificados por la FDA como aquellos para los que una supervisión menos estricta no ponga en peligro la salud pública.
La FDA está en busca de comentarios sobre el proyecto de directrices, de los fabricantes, comunidad médica y comunidades de pacientes. El proyecto está abierto a comentarios durante 90 días.
La FDA, una agencia dentro del Departamento de Salud y Servicios Humanos de los EUA, protege la salud pública asegurando la seguridad y eficacia de los medicamentos humanos y veterinarios, vacunas y otros productos biológicos para uso humano y dispositivos médicos.
Para más información sobre la política de aplicación de los requisitos de notificación previa a la comercialización de determinados dispositivos de diagnóstico in vitro y radiología.
Enlaces relacionados:
US Food and Drug Administration
US FDA Medical Device Regulation and Guidance Document
El proyecto de pautas enumera 30 diferentes tipos de dispositivos, incluyendo análisis comunes de orina y de sangre, pruebas de alcoholemia, pruebas de proteínas coagulación de la sangre y accesorios para dispositivos de radiología, tales como cintas de película, procesadores de películas y digitalizadores. La FDA tiene la intención de eximir a estos dispositivos de los requisitos de notificación previa a la comercialización a través de los procesos de regulación pertinentes. En el ínterin, sin embargo, la FDA no tiene la intención de hacer cumplir los requisitos de notificación previa a la comercialización con respecto a estos dispositivos, siempre que no excedan los límites de exención especificados en los reglamentos de clasificación de dispositivos.
En el futuro, la FDA también tiene la intención de reducir la carga de regulación previa a la comercialización adicionalmente para los tipos de dispositivos de diagnóstico in vitro y de radiología.
“La seguridad y eficacia de estos dispositivos han sido bien demostradas a lo largo de los años”, dijo Jeffrey Shuren, MD, director del Centro para Dispositivos y Salud Radiológica de la FDA. “Al abordar el nivel de riesgo de estos dispositivos, la agencia está adoptando un método inteligente reglamentario que alivie de requisitos innecesarios a los fabricantes, mientras que se asegura de que el público tenga dispositivos seguros y efectivos”.
Los tipos de dispositivos enunciados en el proyecto de directrices incluyen dispositivos identificados por la FDA como aquellos para los que una supervisión menos estricta no ponga en peligro la salud pública.
La FDA está en busca de comentarios sobre el proyecto de directrices, de los fabricantes, comunidad médica y comunidades de pacientes. El proyecto está abierto a comentarios durante 90 días.
La FDA, una agencia dentro del Departamento de Salud y Servicios Humanos de los EUA, protege la salud pública asegurando la seguridad y eficacia de los medicamentos humanos y veterinarios, vacunas y otros productos biológicos para uso humano y dispositivos médicos.
Para más información sobre la política de aplicación de los requisitos de notificación previa a la comercialización de determinados dispositivos de diagnóstico in vitro y radiología.
Enlaces relacionados:
US Food and Drug Administration
US FDA Medical Device Regulation and Guidance Document
Últimas Tecnología noticias
- Algoritmos predictivos avanzados identifican pacientes con cáncer no diagnosticado
- Algoritmo de firma de luz permite diagnósticos médicos más rápidos y precisos
- Tecnología de microchip desechable podría detectar selectivamente VIH en muestras de sangre completa
- Dispositivo microfluídico Dolor en un Chip determina tipos de dolor crónico desde muestras de sangre
- Innovador sensor fluorométrico sin etiquetas permite detección más sensible del ARN viral
- Teléfonos inteligentes podrían diagnosticar enfermedades mediante escáneres infrarrojos
- Nueva tecnología de sensores permite diagnóstico temprano de trastornos metabólicos y cardiovasculares
- Avance en impresión 3D permite desarrollo a gran escala de diminutos dispositivos microfluídicos
- Plataforma de sensores en papel transforma diagnóstico cardíaco
- Estudio explora impacto de pruebas POC en el futuro de los diagnósticos
- Sensor económico de respuesta rápida permite detección temprana y precisa del cáncer de pulmón
- Nanotecnología para diagnósticar cáncer de cuello uterino podría sustituir pruebas de Papanicolaou
- Plataforma de laboratorio en chip agilizar diagnóstico del cáncer
- Plataforma de biosensores detecta simultáneamente vitamina C y SARS-CoV-2
- Nuevo método analiza lágrimas para detectar enfermedades de forma temprana
- Sensores basados en FET abren camino a dispositivos de diagnóstico portátiles para detectar múltiples enfermedades
Canales
Química Clínica
ver canal
Análisis de sangre con IA detecta cáncer de ovario
El cáncer de ovario se ubica como la quinta causa principal de muerte por cáncer en mujeres, debido principalmente a diagnósticos en etapas tardías. Si bien más del 90... Más
Ensayo automatizado y descentralizado de NGS deADNlc identifica alteraciones en tumores sólidos avanzados
Los análisis actuales de ADN libre circulante (ADNlc) suelen estar centralizados, lo que requiere un manejo y transporte especializados de las muestras. La introducción de un sistema de ... MásDiagnóstico Molecular
ver canal
Prueba de hisopado oral POC para aumenta posibilidades de embarazo en la FIV
Aproximadamente el 15 % de las parejas en edad reproductiva experimentan infertilidad involuntaria. Una razón importante para esto es la creciente tendencia a retrasar la planificación familiar,... Más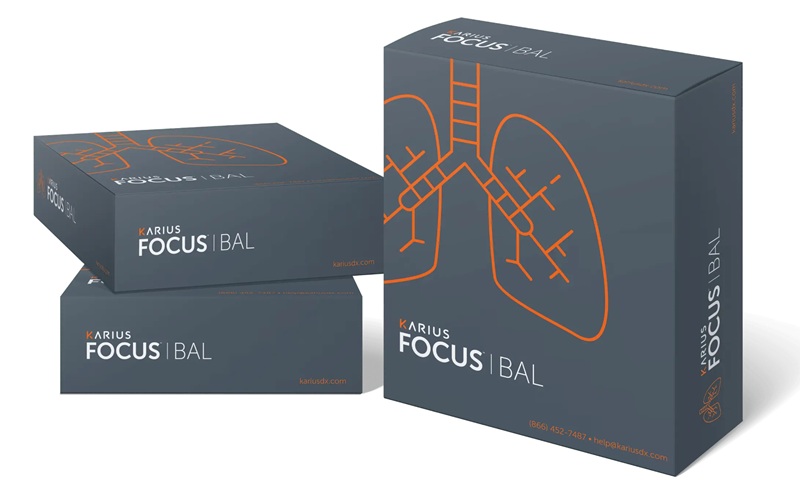
Prueba de ADN microbiano libre de células identifica patógenos de neumonía y otras infecciones pulmonares
El lavado broncoalveolar (BAL) es un procedimiento común para diagnosticar infecciones pulmonares, especialmente en pacientes inmunodeprimidos. Sin embargo, las pruebas estándar a menudo... Más
Método sin biopsia transforma diagnóstico de enfermedad celíaca en adultos
En Estados Unidos, el diagnóstico de la enfermedad celíaca en adultos suele basarse en una combinación de pruebas serológicas y una biopsia confirmatoria del intestino delgado... Más
Innovadora prueba de diagnóstico molecular señala con precisión principal causa genética de EPOC
La enfermedad pulmonar obstructiva crónica (EPOC) y la deficiencia de alfa-1 antitripsina (DAAT) son afecciones que pueden causar dificultades respiratorias, pero difieren en su origen y herencia.... MásHematología
ver canal
Primera prueba de monitorización de heparina POC proporciona resultados rápidos
La dosificación de heparina requiere un manejo cuidadoso para evitar complicaciones hemorrágicas y de coagulación. En situaciones de alto riesgo, como la oxigenación por membrana... Más
Nuevo sistema de puntuación predice riesgo de cáncer a partir de un trastorno sanguíneo común
La citopenia clonal de significado incierto (CCSI) es un trastorno sanguíneo común en adultos mayores, caracterizado por mutaciones en las células sanguíneas y un recuento ... MásInmunología
ver canal
Prueba de células madre predice resultado del tratamiento en cáncer de ovario resistente al platino
El cáncer de ovario epitelial suele responder inicialmente a la quimioterapia, pero con el tiempo, el tumor desarrolla resistencia a la terapia, lo que provoca su recrecimiento. Esta resistencia... Más
Análisis de sangre con aprendizaje automático predice respuesta a inmunoterapia en pacientes con linfoma
La terapia de células T con receptores de antígenos quiméricos (CAR) se ha convertido en uno de los avances recientes más prometedores en el tratamiento de los cánceres... MásMicrobiología
ver canal
Nuevo análisis de sangre detecta hasta cinco enfermedades infecciosas en punto de atención
Los investigadores han desarrollado un prototipo de ensayo de flujo continuo capaz de detectar hasta cinco infecciones diferentes, cuyos resultados pueden analizarse y transmitirse rápidamente mediante... Más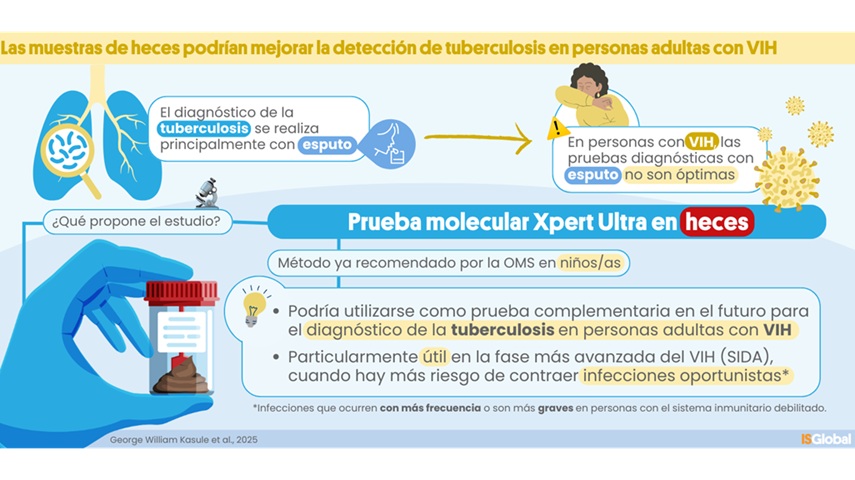
Prueba molecular de heces muestra potencial para diagnosticar tuberculosis en adultos con VIH
La tuberculosis (TB), causada por la bacteria Mycobacterium tuberculosis, provocó 1,25 millones de muertes en 2023, de las cuales el 13 % se produjeron en personas con VIH. El principal método... MásPatología
ver canal
Innovador algoritmo de triaje del dolor torácico transforma la atención cardíaca
Las enfermedades cardiovasculares son responsables de un tercio de las muertes en todo el mundo, y el dolor torácico es la segunda causa más común de visitas a urgencias.... Más
Enfoque de biopsia líquida basado en IA revolucionará detección del cáncer cerebral
Detectar cánceres cerebrales sigue siendo extremadamente difícil, ya que muchos pacientes solo reciben un diagnóstico en etapas avanzadas, tras la aparición de síntomas... MásIndustria
ver canal
Qiagen adquiere Genoox, empresa de software de análisis NGS
QIAGEN (Venlo, Países Bajos) ha firmado un acuerdo definitivo para adquirir Genoox (Tel Aviv, Israel), un proveedor de software impulsado por inteligencia artificial (IA) que permite a los laboratorios... Más