REGEN-COV2 de Regeneron se convierte en el primer coctel de anticuerpos para COVID-19 que recibe autorización AUE de la FDA
|
Por el equipo editorial de LabMedica en español Actualizado el 24 Nov 2020 |
Ilustración
El coctel de anticuerpos casirivimab e imdevimab de Regeneron Pharmaceuticals, Inc. (Tarrytown, NY, EUA), administrados en conjunto (conocido anteriormente como REGN-COV2 o REGEN-COV2), un tratamiento en estudio para su uso en la COVID-19, recibió una Autorización para Uso en Emergencias (AUE) de la Dirección de Alimentos y Medicamentos de los Estados Unidos (FDA).
Casirivimab e imdevimab administrados en conjunto, están autorizados para el tratamiento de la COVID-19 leve a moderada en adultos, así como en pacientes pediátricos mayores de 12 años de edad y que pesen al menos 40 kg, que hayan dado resultados positivos para las pruebas virales directas de SARS-CoV-2 y tengan un alto riesgo de evolucionar a COVID-19 grave y/u hospitalización. Dicha autorización se basa en los datos positivos de la Fase 2 anunciados en septiembre y octubre, de los primeros 799 adultos incluidos en un estudio aleatorizado, doble ciego y controlado con placebo, que se halla en curso con pacientes de COVID-19 no hospitalizados (ambulatorios). La evidencia clínica del estudio de Regeneron con pacientes ambulatorios sugiere que los anticuerpos monoclonales como casirivimab e imdevimab ofrecen el mayor beneficio cuando se administran poco después del diagnóstico y en pacientes que aún no han desarrollado su propia respuesta inmune o que tienen una carga viral alta.
Según la AUE, la dosis recomendada es de 1.200 mg de casirivimab y 1.200 mg de imdevimab (2.400 mg en total), administrados como una única inyección intravenosa. Casirivimab e imdevimab no están autorizados para uso en pacientes hospitalizados o que requieran oxigenoterapia debido a COVID-19, ni para personas que actualmente usan oxigenoterapia crónica debido a una comorbilidad subyacente que requiere un aumento en la tasa de flujo del oxígeno inicial, debido a la COVID-19. El tratamiento con casirivimab e imdevimab combinados continuará en evaluación en los estudios clínicos de fases 2 y 3 para el tratamiento de COVID-19 en ciertos pacientes hospitalizados y no hospitalizados, el estudio abierto de fase 3 RECOVERY con pacientes hospitalizados en el Reino Unido y un estudio de fase 3 para la prevención de la COVID-19 en contactos domésticos con personas infectadas.
Regeneron aumentó rápidamente la producción de casirivimab e imdevimab, y espera tener listas las dosis de tratamiento para aproximadamente 80.000 pacientes para fines de noviembre, aproximadamente para 200.000 pacientes en la primera semana de enero y aproximadamente para 300.000 pacientes en total para fines de enero de 2021.
“Esta Autorización para Uso en Emergencias de la FDA es un paso importante en la lucha contra la COVID-19, ya que los pacientes de alto riesgo de los Estados Unidos tendrán acceso a un tratamiento prometedor en las primeras etapas del curso de su infección”, dijo el Dr. Leonard S. Schleifer, M.D., Ph.D., presidente y director ejecutivo de Regeneron. “Las inversiones en ciencia y tecnología que Regeneron ha realizado durante tres décadas nos posicionaron para movernos rápidamente con el fin de desarrollar, estudiar y maximizar la producción de nuestro coctel de anticuerpos. Incluso con estos increíbles esfuerzos, la demanda puede exceder la oferta inicialmente, por lo que es aún más crítico que los gobiernos federal y estatal garanticen que el coctel de anticuerpos de casirivimab e imdevimab se distribuya de manera justa y equitativa a los pacientes más necesitados. En el primer trimestre de 2021, esperamos aumentar la oferta mundial disponible a medida que continuamos nuestro trabajo conjunto con Roche”.
“El coctel de anticuerpos con casirivimab e imdevimab fue diseñado para imitar lo que hace un sistema inmune que funciona bien, pues usa anticuerpos muy potentes para neutralizar el virus”, dijo George D. Yancopoulos, MD, Ph.D., presidente y director científico de Regeneron. “Los datos de aproximadamente 800 pacientes no hospitalizados mostraron reducciones significativas en los niveles de virus a los pocos días de recibir esta combinación, lo cual se relaciona con un número significativamente menor de consultas médicas. Este beneficio fue mayor en los pacientes con mayor riesgo de mostrar una respuesta desfavorable por presentar una alta carga viral, una respuesta inmune ineficaz al inicio del estudio o factores de riesgo preexistentes. Nos alienta que hasta la fecha no se han encontrado variantes resistentes a este coctel en los análisis de los estudios clínicos, lo cual es consistente con nuestros hallazgos preclínicos. También estamos muy entusiasmados con los resultados de vacunas prometedoras anunciados recientemente; sin embargo, sigue existiendo la necesidad de tratar a los pacientes que desarrollan COVID-19, especialmente porque algunos pueden no haber tenido acceso o no haber estado protegidos por la vacunación. Es importante destacar que continuamos avanzando en nuestro riguroso programa de estudios clínicos que evalúan la seguridad y eficacia del coctel de anticuerpos tanto para el tratamiento como para la prevención de la COVID-19 y compartiremos nuevos resultados a medida que estén disponibles”.
Enlace relacionado:
Regeneron Pharmaceuticals, Inc.
Casirivimab e imdevimab administrados en conjunto, están autorizados para el tratamiento de la COVID-19 leve a moderada en adultos, así como en pacientes pediátricos mayores de 12 años de edad y que pesen al menos 40 kg, que hayan dado resultados positivos para las pruebas virales directas de SARS-CoV-2 y tengan un alto riesgo de evolucionar a COVID-19 grave y/u hospitalización. Dicha autorización se basa en los datos positivos de la Fase 2 anunciados en septiembre y octubre, de los primeros 799 adultos incluidos en un estudio aleatorizado, doble ciego y controlado con placebo, que se halla en curso con pacientes de COVID-19 no hospitalizados (ambulatorios). La evidencia clínica del estudio de Regeneron con pacientes ambulatorios sugiere que los anticuerpos monoclonales como casirivimab e imdevimab ofrecen el mayor beneficio cuando se administran poco después del diagnóstico y en pacientes que aún no han desarrollado su propia respuesta inmune o que tienen una carga viral alta.
Según la AUE, la dosis recomendada es de 1.200 mg de casirivimab y 1.200 mg de imdevimab (2.400 mg en total), administrados como una única inyección intravenosa. Casirivimab e imdevimab no están autorizados para uso en pacientes hospitalizados o que requieran oxigenoterapia debido a COVID-19, ni para personas que actualmente usan oxigenoterapia crónica debido a una comorbilidad subyacente que requiere un aumento en la tasa de flujo del oxígeno inicial, debido a la COVID-19. El tratamiento con casirivimab e imdevimab combinados continuará en evaluación en los estudios clínicos de fases 2 y 3 para el tratamiento de COVID-19 en ciertos pacientes hospitalizados y no hospitalizados, el estudio abierto de fase 3 RECOVERY con pacientes hospitalizados en el Reino Unido y un estudio de fase 3 para la prevención de la COVID-19 en contactos domésticos con personas infectadas.
Regeneron aumentó rápidamente la producción de casirivimab e imdevimab, y espera tener listas las dosis de tratamiento para aproximadamente 80.000 pacientes para fines de noviembre, aproximadamente para 200.000 pacientes en la primera semana de enero y aproximadamente para 300.000 pacientes en total para fines de enero de 2021.
“Esta Autorización para Uso en Emergencias de la FDA es un paso importante en la lucha contra la COVID-19, ya que los pacientes de alto riesgo de los Estados Unidos tendrán acceso a un tratamiento prometedor en las primeras etapas del curso de su infección”, dijo el Dr. Leonard S. Schleifer, M.D., Ph.D., presidente y director ejecutivo de Regeneron. “Las inversiones en ciencia y tecnología que Regeneron ha realizado durante tres décadas nos posicionaron para movernos rápidamente con el fin de desarrollar, estudiar y maximizar la producción de nuestro coctel de anticuerpos. Incluso con estos increíbles esfuerzos, la demanda puede exceder la oferta inicialmente, por lo que es aún más crítico que los gobiernos federal y estatal garanticen que el coctel de anticuerpos de casirivimab e imdevimab se distribuya de manera justa y equitativa a los pacientes más necesitados. En el primer trimestre de 2021, esperamos aumentar la oferta mundial disponible a medida que continuamos nuestro trabajo conjunto con Roche”.
“El coctel de anticuerpos con casirivimab e imdevimab fue diseñado para imitar lo que hace un sistema inmune que funciona bien, pues usa anticuerpos muy potentes para neutralizar el virus”, dijo George D. Yancopoulos, MD, Ph.D., presidente y director científico de Regeneron. “Los datos de aproximadamente 800 pacientes no hospitalizados mostraron reducciones significativas en los niveles de virus a los pocos días de recibir esta combinación, lo cual se relaciona con un número significativamente menor de consultas médicas. Este beneficio fue mayor en los pacientes con mayor riesgo de mostrar una respuesta desfavorable por presentar una alta carga viral, una respuesta inmune ineficaz al inicio del estudio o factores de riesgo preexistentes. Nos alienta que hasta la fecha no se han encontrado variantes resistentes a este coctel en los análisis de los estudios clínicos, lo cual es consistente con nuestros hallazgos preclínicos. También estamos muy entusiasmados con los resultados de vacunas prometedoras anunciados recientemente; sin embargo, sigue existiendo la necesidad de tratar a los pacientes que desarrollan COVID-19, especialmente porque algunos pueden no haber tenido acceso o no haber estado protegidos por la vacunación. Es importante destacar que continuamos avanzando en nuestro riguroso programa de estudios clínicos que evalúan la seguridad y eficacia del coctel de anticuerpos tanto para el tratamiento como para la prevención de la COVID-19 y compartiremos nuevos resultados a medida que estén disponibles”.
Enlace relacionado:
Regeneron Pharmaceuticals, Inc.
Últimas COVID-19 noticias
- Inmunosensor nuevo allana el camino para pruebas rápidas POC para COVID-19 y enfermedades infecciosas emergentes
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Prueba nueva COVID + Influenza + VSR ayudará a estar preparados para la ‘tripledemia’
- IA elimina las conjeturas de las pruebas de flujo lateral
- Prueba de antígeno del SARS-CoV-2 más rápida, jamás diseñada, permite realizar pruebas de COVID-19 no invasivas en cualquier entorno
- Pruebas rápidas de antígeno detectan las variantes ómicron, delta del SARS-CoV-2
- Prueba en sangre realizada durante la infección inicial predice el riesgo de COVID prolongada
- Investigadores afirman que hay que crear “reservistas” de laboratorio para responder más rápidamente a la próxima pandemia
- Estudio encuentra que los profesionales sanitarios mostraron mayor interés en tecnologías POC durante la pandemia
- Plataforma de análisis de bajo costo para la COVID-19 combina sensibilidad de la PCR y velocidad de pruebas de antígeno
- Prueba de sangre por punción digital identifica inmunidad a la COVID-19
- Kit de prueba rápida determina inmunidad contra la COVID-19 y sus variantes
Canales
Química Clínica
ver canal
Modelo pronóstico basado en APE mejora evaluación del riesgo de cáncer
El cáncer de próstata es la segunda causa principal de muerte por cáncer en los hombres estadounidenses, y aproximadamente uno de cada ocho será diagnosticado a lo largo de su vida.... Más
Vesículas extracelulares se relacionan con riesgo de insuficiencia cardíaca en pacientes con ERC
La enfermedad renal crónica (ERC) afecta a más de 1 de cada 7 estadounidenses y está estrechamente asociada con complicaciones cardiovasculares, las cuales representan más de... MásDiagnóstico Molecular
ver canal
Dispositivo de diagnóstico predice respuesta al tratamiento de tumores cerebrales mediante análisis sanguíneo
El glioblastoma es uno de los tipos más mortales de cáncer cerebral, en gran parte porque los médicos no cuentan con un método fiable para determinar la eficacia de los tratamientos... Más
Análisis sanguíneo detecta cánceres en etapa temprana midiendo inestabilidad epigenética
Los cánceres en etapa temprana son notoriamente difíciles de detectar debido a que los cambios moleculares son sutiles y a menudo pasan desapercibidos para las herramientas de detección... MásHematología
ver canal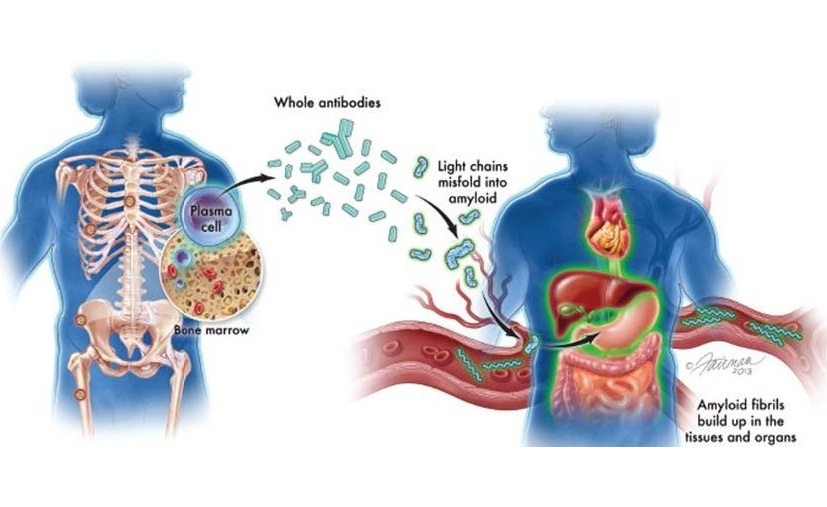
Nuevas directrices buscan mejorar diagnóstico de amiloidosis AL
La amiloidosis de cadenas ligeras (AL) es un trastorno poco común y potencialmente mortal de la médula ósea, en el que las proteínas amiloides anormales se acumulan en los órganos. Aproximadamente 3.... Más
Sistema automatizado de hemostasia ayuda a laboratorios a optimizar flujo de trabajo
Las secciones de hemostasia de alto volumen requieren una rápida respuesta, a la vez que gestionan repeticiones y pruebas reflejas. La manipulación de los tubos y las comprobaciones prea... MásInmunología
ver canalAnálisis de sangre identifica pacientes con cáncer pulmonar beneficiarios de fármaco de inmunoterapia
El cáncer de pulmón de células pequeñas (CPCP) es una enfermedad agresiva con opciones de tratamiento limitadas, e incluso las inmunoterapias recientemente aprobadas no benefician... Más
Enfoque de secuenciación genómica completa identifica pacientes con cáncer beneficiarios con inhibidores de PARP
Las terapias dirigidas contra el cáncer, como los inhibidores de PARP, pueden ser muy eficaces, pero solo en pacientes cuyos tumores presentan defectos específicos en la reparación del ADN.... MásMicrobiología
ver canal
Nuevo estudio identifica características del microbioma intestinal asociadas con enfermedad de Alzheimer
La enfermedad de Alzheimer afecta a aproximadamente 6,7 millones de personas en Estados Unidos y a casi 50 millones en todo el mundo; sin embargo, el deterioro cognitivo temprano sigue siendo difícil de... MásPlataforma de IA permite detección rápida de patógenos de C. auris resistentes a fármacos
Las infecciones causadas por la levadura patógena Candida auris representan una amenaza significativa para los pacientes hospitalizados, en particular para aquellos con sistemas inmunitarios debilitados... MásPatología
ver canal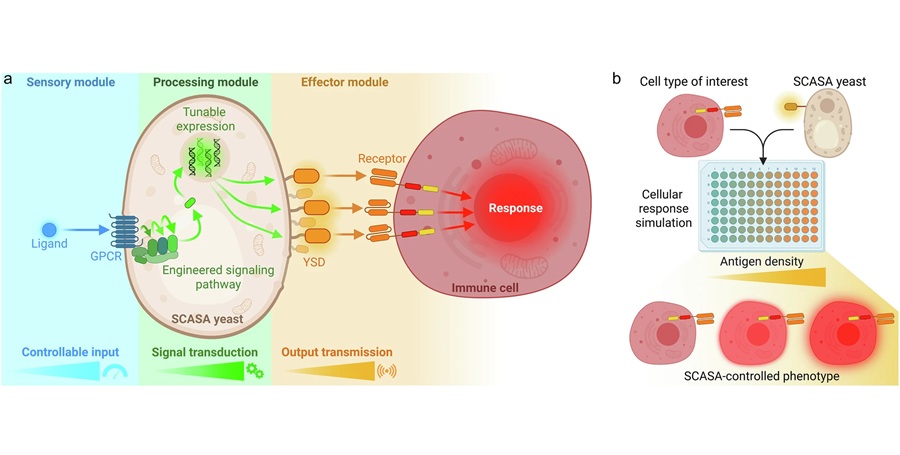
Células de levadura modificadas permiten pruebas rápidas de inmunoterapia contra cáncer
El desarrollo de nuevas inmunoterapias contra el cáncer es un proceso lento, costoso y de alto riesgo, especialmente para los tratamientos con células CAR-T, que deben reconocer con precisión... Más
Prueba pionera identifica riesgo de autismo al nacer
El trastorno del espectro autista es tratable, y una amplia investigación demuestra que la intervención temprana puede mejorar significativamente los resultados cognitivos, sociales y conductuales.... MásTecnología
ver canal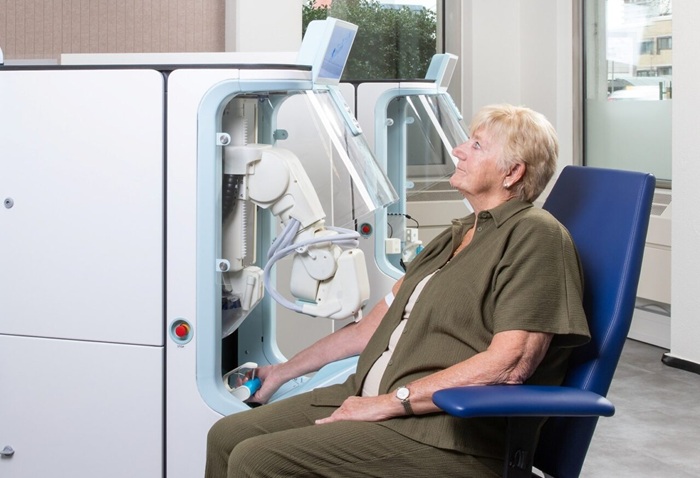
Tecnología robótica para extracciones de sangre diagnósticas automatizadas
La extracción rutinaria de sangre para diagnóstico es una tarea de alto volumen que puede sobrecargar al personal e introducir variabilidad dependiente del factor humano, con implicaciones... Más
ADLM lanza programa de ciencia de datos único para profesionales de medicina de laboratorio
Los laboratorios clínicos generan miles de millones de resultados de pruebas cada año, lo que crea un cúmulo de datos con el potencial de facilitar pruebas más personalizadas,... MásIndustria
ver canal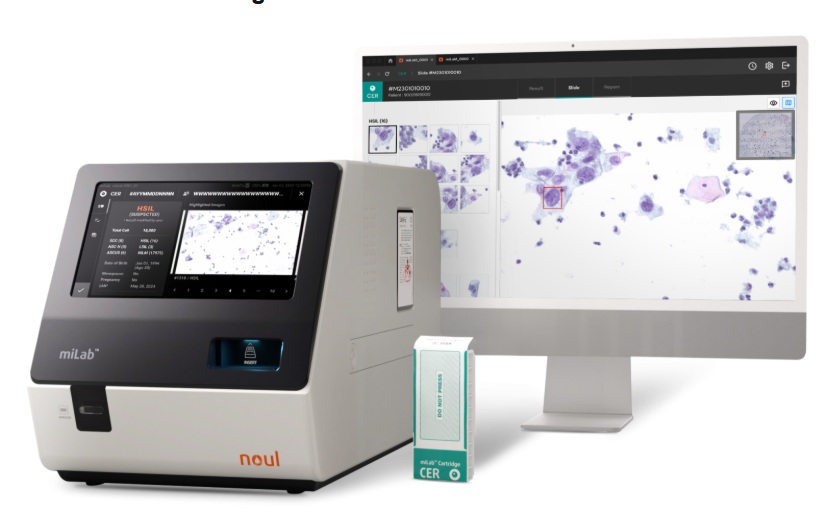
Prueba de cáncer cervical con IA lista para lanzamiento en América Latina
Noul Co., una empresa coreana especializada en diagnósticos de sangre y cáncer basados en IA, anunció que suministrará su solución de diagnóstico de cáncer... MásNueva colaboración lleva espectrometría de masas automatizada a pruebas de laboratorio de rutina
La espectrometría de masas es una potente técnica analítica que identifica y cuantifica moléculas en función de su masa y carga eléctrica. Su alta selectividad,... Más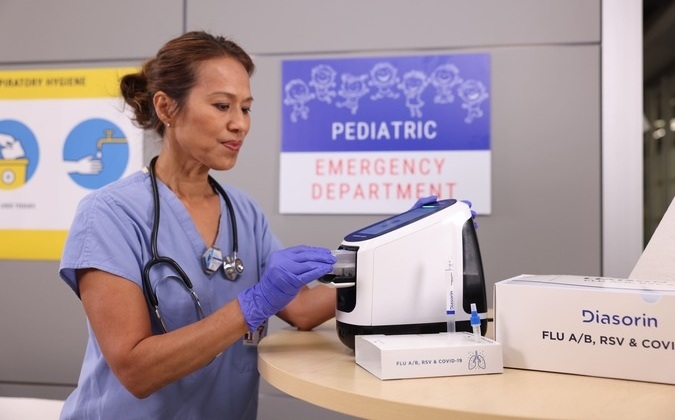
Diasorin y Fisher Scientific firman acuerdo de distribución en EUA para plataforma POC molecular
Diasorin (Saluggia, Italia) ha firmado un acuerdo de distribución exclusivo con Fisher Scientific, parte de Thermo Fisher Scientific (Waltham, MA, EUA), para la plataforma molecular de punto de... Más