Descubren método simplificado para tratar cáncer intestinal
|
Por el equipo editorial de LabMedica en español Actualizado el 10 May 2018 |
Imagen: El nuevo método simplificado descubierto para diagnosticar y tratar el cáncer de intestino (Fotografía cortesía de la Universidad de Adelaida).
Más de 4.000 australianos mueren de cáncer de intestino cada año, y más de 17,000 nuevos casos de este cáncer serán diagnosticados en 2018. Los científicos trabajan atualmente para comprender los factores genéticos del cáncer de intestino, con un interés especial en los cánceres que son más difíciles de tratar, y que tienen el peor pronóstico.
Un nuevo método ayuda a determinar qué cambios de ADN son importantes para el cáncer, en una fracción del tiempo, a un menor costo y utilizando menos animales que los modelos tradicionales de ingeniería genética que se utilizan en la investigación del cáncer. El análisis de los modelos, combinado con los datos de los pacientes, ha sugerido posibles vulnerabilidades de las drogas en estudio.
Un equipo internacional de científicos dirigido por personas de la Universidad de Adelaida (Adelaida, Australia) han descubierto una forma más rápida y económica de determinar qué mutaciones de ADN causan el cáncer de intestino humano. El cáncer colorrectal serrado (CCR) representa aproximadamente el 25% de los casos e incluye tumores que se encuentran entre los más resistentes al tratamiento y con los peores resultados. Este subtipo de CCR está asociado con la activación de mutaciones en el gen de la ruta de la quinasa activada por mitógenos, BRAF, y con modificaciones epigenéticas denominadas CpG Island Methylator Phenotype, que conducen al silenciamiento epigenético de genes clave supresores de tumores. El equipo utilizó el cultivo de organoides combinado con la ingeniería del genoma CRISPR/Cas9 para introducir secuencialmente alteraciones genéticas asociadas con el CCR dentado y que regulan el nicho de las células madre, la senescencia y la reparación del mal apareamiento del ADN.
Los científicos informaron que se verificaron las alteraciones del gen bialélico diana mediante la secuenciación del ADN. Se evaluó el crecimiento de organoides en ausencia de factores de nicho, así como el análisis de la actividad de las vías moleculares aguas abajo. El injerto ortotópico de líneas de organoides complejos, pero no BrafV600E solo, generó rápidamente adenocarcinomas in vivo con características serradas compatibles con la enfermedad humana. La pérdida de la enzima esencial de reparación del mal apareamiento del ADN, MutL Homolog 1 (Mlh1), condujo a la inestabilidad de los microsatélites. Los genes del metabolismo de los esfingolípidos están regulados de manera diferencial en ambos modelos de CCR serrado y de CCR humano en ratones, y los miembros clave de esta vía tienen importancia pronóstica en el entorno humano.
Los autores concluyeron que habían generado modelos rápidos y complejos de CCR serrado para determinar la contribución de alteraciones genéticas específicas a la carcinogénesis. El análisis de los modelos junto con los datos del paciente ha llevado a la identificación de una susceptibilidad potencial para este tipo de tumor. Susan L. Woods, PhD, investigadora principal y codirectora del estudio, dijo: “Ahora, hemos creado rápidamente nuevos modelos de cáncer intestinal que imitan los complejos cambios genéticos (ADN) que vemos en los tumores humanos y recapitulamos las características de la enfermedad humana”. El estudio fue publicado el 17 de abril de 2018 en la revista GUT.
Un nuevo método ayuda a determinar qué cambios de ADN son importantes para el cáncer, en una fracción del tiempo, a un menor costo y utilizando menos animales que los modelos tradicionales de ingeniería genética que se utilizan en la investigación del cáncer. El análisis de los modelos, combinado con los datos de los pacientes, ha sugerido posibles vulnerabilidades de las drogas en estudio.
Un equipo internacional de científicos dirigido por personas de la Universidad de Adelaida (Adelaida, Australia) han descubierto una forma más rápida y económica de determinar qué mutaciones de ADN causan el cáncer de intestino humano. El cáncer colorrectal serrado (CCR) representa aproximadamente el 25% de los casos e incluye tumores que se encuentran entre los más resistentes al tratamiento y con los peores resultados. Este subtipo de CCR está asociado con la activación de mutaciones en el gen de la ruta de la quinasa activada por mitógenos, BRAF, y con modificaciones epigenéticas denominadas CpG Island Methylator Phenotype, que conducen al silenciamiento epigenético de genes clave supresores de tumores. El equipo utilizó el cultivo de organoides combinado con la ingeniería del genoma CRISPR/Cas9 para introducir secuencialmente alteraciones genéticas asociadas con el CCR dentado y que regulan el nicho de las células madre, la senescencia y la reparación del mal apareamiento del ADN.
Los científicos informaron que se verificaron las alteraciones del gen bialélico diana mediante la secuenciación del ADN. Se evaluó el crecimiento de organoides en ausencia de factores de nicho, así como el análisis de la actividad de las vías moleculares aguas abajo. El injerto ortotópico de líneas de organoides complejos, pero no BrafV600E solo, generó rápidamente adenocarcinomas in vivo con características serradas compatibles con la enfermedad humana. La pérdida de la enzima esencial de reparación del mal apareamiento del ADN, MutL Homolog 1 (Mlh1), condujo a la inestabilidad de los microsatélites. Los genes del metabolismo de los esfingolípidos están regulados de manera diferencial en ambos modelos de CCR serrado y de CCR humano en ratones, y los miembros clave de esta vía tienen importancia pronóstica en el entorno humano.
Los autores concluyeron que habían generado modelos rápidos y complejos de CCR serrado para determinar la contribución de alteraciones genéticas específicas a la carcinogénesis. El análisis de los modelos junto con los datos del paciente ha llevado a la identificación de una susceptibilidad potencial para este tipo de tumor. Susan L. Woods, PhD, investigadora principal y codirectora del estudio, dijo: “Ahora, hemos creado rápidamente nuevos modelos de cáncer intestinal que imitan los complejos cambios genéticos (ADN) que vemos en los tumores humanos y recapitulamos las características de la enfermedad humana”. El estudio fue publicado el 17 de abril de 2018 en la revista GUT.
Últimas Diagnóstico Molecular noticias
- Firma genética en recién nacidos predice sepsis antes de que aparezcan síntomas
- Integración de marcadores proteicos predice resultados de salud en pacientes con enfermedad renal crónica
- Prueba rápida de sangre mediante punción digital detecta sífilis activa en el punto de atención
- Análisis de orina podrían revelar signos tempranos de cáncer y otras enfermedades
- Sistema de PCR inteligente con IA revolucionará diagnóstico clínico
- Análisis de sangre identifica mujeres en trabajo de parto con riesgo de preeclampsia
- Prueba en papel POC podría diagnosticar cáncer en la cabecera
- Prueba de sepsis demuestra utilidad clínica en poblaciones heterogéneas de pacientes gravemente enfermos
- Prueba para múltiples cánceres mide respuesta del huésped al desarrollo del tumor
- Prueba basada en microARN identifica 12 cánceres en cualquier etapa
- Nuevo análisis de sangre mide simultáneamente más de 100 biomarcadores de enfermedad de Alzheimer

- Análisis de sangre diagnostica autismo relacionado con autoanticuerpos maternos
- Prueba de sangre de medicina de precisión predice la enfermedad cardíaca
- Prueba de PCR guía terapia para Alzheimer
- Análisis de sangre predice supervivencia en pacientes con cáncer de próstata metastásico
- Prueba de sepsis en POC ofrece resultados rápidos y precisos en entornos de cuidados intensivos
Canales
Química Clínica
ver canal
Dispositivo de pruebas de saliva predice la insuficiencia cardíaca en 15 minutos
La insuficiencia cardíaca es una enfermedad grave en la que el músculo cardíaco no puede bombear suficiente sangre rica en oxígeno a todo el cuerpo. Se considera una de las... Más
Herramienta de diagnóstico identifica múltiples condiciones de salud a partir de una sola gota de sangre
La espectroscopía infrarroja, un método que utiliza luz infrarroja para estudiar la composición molecular de las sustancias, ha sido una herramienta fundamental en la química durante décadas.... Más
Un analizador integrado de química e inmunoensayo con extenso menú de ensayos ofrece flexibilidad, escalabilidad y conmutabilidad de datos
A medida que los sistemas sanitarios mundiales cambian cada vez más hacia modelos operativos de laboratorios en red para mejorar la eficiencia y el acceso de los pacientes, existe una mayor necesidad... MásHematología
ver canal.jpg)
Sistema de diagnóstico de hemograma completo y sepsis busca resultados más rápidos, tempranos y fáciles
Cada hora es crucial para proteger a los pacientes de las infecciones, pero actualmente existen herramientas limitadas para ayudar a un diagnóstico temprano antes de que los pacientes lleguen al hospital.... Más
Nuevo grupo sanguíneo descubierto ayudará a identificar y tratar a pacientes
El antígeno del grupo sanguíneo AnWj, un marcador de superficie descubierto en 1972, ha sido un misterio en cuanto a su origen genético, hasta ahora. La causa más común... MásInmunología
ver canal
Biomarcador podría predecir respuesta a inmunoterapia en cáncer de hígado
Hasta hace poco, los pacientes con diagnóstico de carcinoma hepatocelular contaban con opciones de tratamiento limitadas, ya que las terapias existentes prolongaban la vida solo unos pocos meses.... Más
Prueba epigenética podría determinar eficacia de nuevos tratamientos de inmunoterapia contra mieloma múltiple
El mieloma múltiple es un cáncer de la sangre que afecta principalmente a personas mayores de sesenta años y su incidencia aumenta a medida que la población envejece.... MásMicrobiología
ver canal
Prueba de cabecera de alta precisión diagnostica infección articular periprotésica en cinco minutos
La infección articular periprotésica (IAP) representa un problema global significativo que está empeorando a medida que aumenta el número de reemplazos articulares debido al... Más_1_1.jpg)
Enfoque innovador para diagnóstico de infecciones bacterianas permitirá un tratamiento más rápido y eficaz
En el caso de los pacientes con infecciones bacterianas, el tratamiento oportuno con los antibióticos adecuados mejora significativamente sus posibilidades de recuperación. Los métodos actuales para identificar... Más
Análisis de heces diagnostica endometriosis y ayuda a reducir progresión de la enfermedad
La endometriosis, una enfermedad dolorosa que afecta a casi 200 millones de mujeres en todo el mundo, se produce cuando un tejido similar al revestimiento del útero crece fuera de su ubicación... Más
Plataforma de preparación de muestras de hemocultivos positivos diseñada para combatir sepsis y resistencia a antimicrobianos
La administración tardía de antibióticos a pacientes con infecciones del torrente sanguíneo aumenta significativamente el riesgo de morbilidad y mortalidad. Para obtener resultados... MásPatología
ver canal.jpg)
Método de diagnóstico por imágenes facilita diagnósticos precisos para cánceres de cabeza y cuello
Los cánceres de cabeza y cuello, aunque se consideran poco frecuentes, representan una parte importante de los casos de cáncer y han experimentado un notable aumento en los últimos 30 años.... Más
Medición más rápida de huella vibratoria de moléculas avanza en el diagnóstico biomédico
Identificar diferentes tipos de moléculas y células es un proceso vital tanto en la ciencia básica como en la aplicada. La espectroscopia Raman es una técnica de medición... MásPrueba clínica de anticuerpos detecta rápidamente incluso niveles bajos de infecciones parasitarias comunes
Las enfermedades tropicales desatendidas abarcan una variedad de afecciones que afectan a millones de personas en todo el mundo, principalmente en regiones empobrecidas, pero a menudo carecen del enfoque... MásTecnología
ver canal
Métodos no invasivos detectan exposición al plomo de forma más rápida, sencilla y precisa en POC
La exposición al plomo puede afectar negativamente la salud de múltiples maneras, provocando daños en el cerebro y el sistema nervioso central, retrasos en el desarrollo y el crecimiento,... Más
Prueba no invasiva detecta malaria sin muestra sanguínea
La malaria sigue siendo un problema de salud mundial importante, con aproximadamente 250 millones de casos y más de 600.000 muertes registradas anualmente. Casi la mitad de la población mundial... Más
Dispositivo portátil detecta cáncer colorrectal y de próstata en una hora
La detección temprana de biomarcadores de cáncer antes de que la enfermedad progrese mejora significativamente las posibilidades de supervivencia del paciente. Las demoras en las pruebas,... Más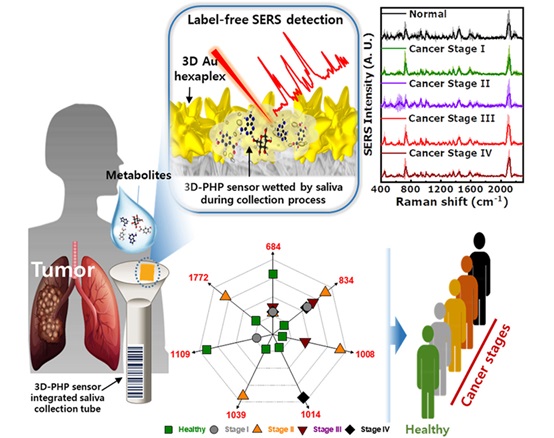
Tecnología Light-AI para diagnóstico del cáncer eliminaría necesidad de extracciones de sangre y biopsias tradicionales
Existen numerosos casos de perros que ladran tanto a sus dueños que estos sospechan que algo anda mal, lo que los lleva a visitar a un médico y, finalmente, a recibir un diagnóstico... MásIndustria
ver canal
Beckman Coulter se asocia con BioPorto para distribución global de pruebas NGAL para lesiones renales agudas
La lesión renal aguda (LRA) es un episodio repentino de insuficiencia o daño renal que puede ocurrir en cuestión de horas o días. Esta afección provoca la acumulación... Más_1.jpg)