Identifican mutaciones en ARN viral en muestras clínicas
Por el equipo editorial de LabMedica en español
Actualizado el 18 Dec 2015
La reacción en cadena de la polimerasa por gotita digital (ddPCR) utiliza la química de emulsión para dividir las muestras de ácidos nucleicos en aproximadamente 20.000 nanogotas encapsuladas en aceite para producir datos que superan la precisión de otros métodos moleculares con una sensibilidad equivalente o mucho mayor.Actualizado el 18 Dec 2015
Numerosas circunstancias pueden conducir a un debilitamiento del sistema inmunológico, haciendo que el cuerpo sea más susceptible a la infección viral y saber si la infección está desarrollando resistencia a ciertos medicamentos es clave para proporcionar un tratamiento óptimo, puesto que la resistencia a menudo puede desarrollarse a partir de una única mutación puntual espontánea en el ácido ribonucleico (ARN) viral.

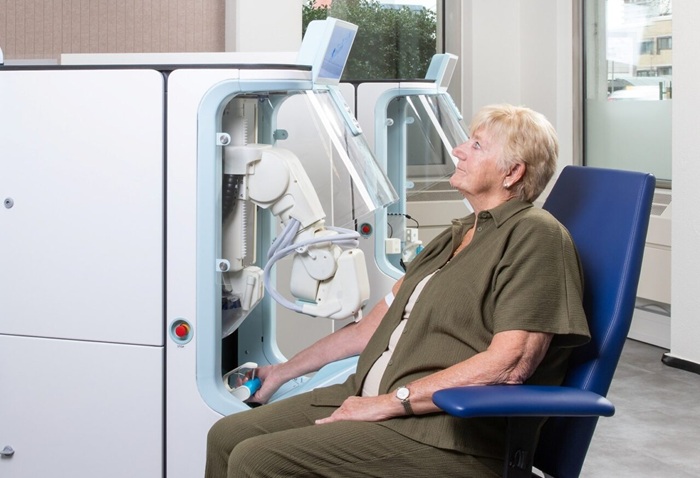
Imagen: El sistema QX200 AutoDG de Gotita Digital para la reacción en cadena de la polimerasa (ddPCR) (Fotografía cortesía de Bio-Rad).
Los científicos en el Hospital de la Universidad Central y de la Universidad Laval (Ciudad de Quebec, QC, Canadá), quienes trabajaron con sus colegas, compararon la abundancia porcentual de mutaciones entre las plataformas ddPCR y de PCR cuantitativa de transcripción reversa (RT-qPCR), en extractos de ácidos nucleicos de muestras de pacientes que habían sido recolectadas en el tiempo. La influenza A (H1N1) por el virus pdm09, fue diagnosticado el 5 de enero de 2011, en un niño de 31 meses de edad con meduloblastoma quien recibió quimioterapia de consolidación para la preparación de un trasplante autólogo de médula ósea.
El proceso de amplificación para la RT-qPCR fue realizado en un termociclador LightCycler 480 en tiempo real (Roche Applied Science, Mannheim, Alemania). Para todas las reacciones de escisión entre la RT-qPCR y la ddPCR, se realizó el proceso de amplificación en un termociclador LightCycler 480, en tiempo real, usando el protocolo de ciclos optimizados para la ddPCR. Para la ddPCR 20 µL de cada mezcla de reacción fue convertida en gotitas con el generador de gotas QX200 (Bio-Rad; Hércules, CA, EUA). Las muestras de gotitas particionadas fueron transferidas a una placa de 96 pozos, selladas y cicladas en un termociclador Bio-Rad C1000 de pozo profundo.
Los científicos utilizaron una mezcla de ARN viral de tipo salvaje y mutante y para mostrar que la tecnología ddPCR aumentó notablemente la sensibilidad en más de 30 veces y la precisión en más de 10 veces, tanto para la variabilidad inter e intra-ensayo de la cuantificación de la abundancia de la mutación en comparación con la RT-qPCR. Debido a que la ddPCR se basa en la cuantificación absoluta, puede eliminar gran parte de la variabilidad intrínseca de la RT-qPCR, que se basa en la cuantificación relativa. Los investigadores descubrieron una correlación estadísticamente significativa entre los dos conjuntos de datos independientes de la ddPCR que no se encontró con la RT-qPCR, lo que permite la identificación exacta de una población viral mutante residual.
Guy Boivin, MD, MSc, FRCPC, profesor asociado de microbiología y autor principal del estudio, dijo: “La investigación de la influenza, especialmente la investigación traslacional, necesita métodos rápidos y reproducibles. Tenemos la intención de utilizar la PCR de gotitas digitales para seguir el destino de los pacientes inmunocomprometidos con terapia antiviral”. El estudio fue publicado en la edición de noviembre 2015 de la revista Journal of Virological Methods.
Enlaces relacionados:
Central University Hospital and Laval University
Roche Applied Science
Bio-Rad Laboratories