Descubren mecanismos de control nuevo en el sistema inmune innato
Por el equipo editorial de LabMedica en español
Actualizado el 10 Feb 2021
Las proteasas son enzimas que escinden otras proteínas. Muy a menudo, las proteasas ocurren en redes en cascada, donde un evento particular desencadena una reacción en cadena en la que varias proteasas se escinden y, por lo tanto, se activan entre sí. La más conocida es probablemente la cascada de coagulación, que provoca la coagulación de nuestra sangre cuando se perfora un vaso.Actualizado el 10 Feb 2021
El inter-α-inhibidor de la cadena pesada 4 (ITIH4) es una proteína plasmática producida por el hígado que pertenece a la familia de proteínas inter-α-inhibidor/ITIH que consta de bikunina y seis proteínas de cadena pesada diferentes. Esta familia de proteínas también se conoce como proteínas inhibidoras de la inter-α-tripsina, ya que la bikunina muestra un efecto inhibidor débil sobre las proteasas para las que aún no se ha definido una función biológica.
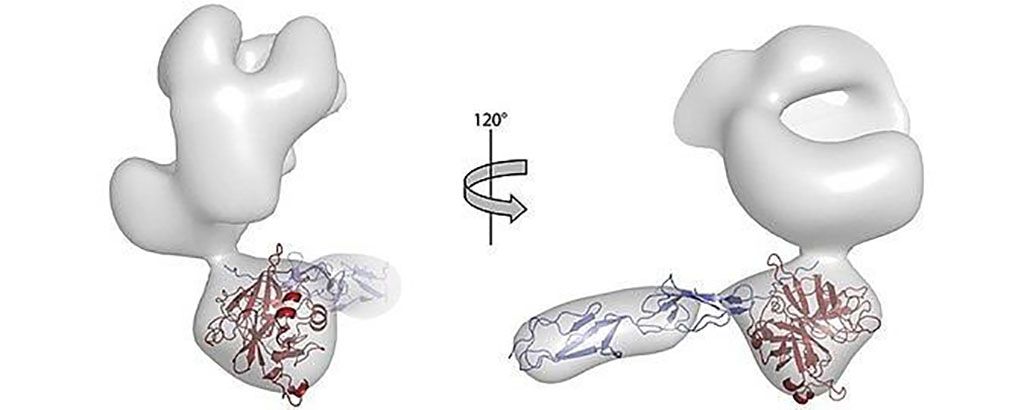
Imagen: El inter-α-inhibidor de la cadena pesada 4 (ITIH4) inhibe las proteasas en el sistema inmunológico innato a través de un nuevo mecanismo inhibidor (Fotografía cortesía de Rasmus Kjeldsen Jensen, PhD).
Científicos biomédicos de la Universidad de Aarhus (Aarhus, Dinamarca) y un colega, investigaron qué otras proteínas en la sangre, las denominadas proteasas de serina proteasa, asociadas a lectina de unión a manano (MASP), interactúan con la cascada del complemento. Para caracterizar en detalle cómo ITIH4 inhibe las proteasas MASP, aislaron tanto ITIH4 libre como ITIH4 unido a la proteasa MASP-1. Mediante el uso de dispersión de ángulo pequeño de rayos X y microscopía electrónica, se estudiaron estas muestras. La espectrometría de masas en tándem con cromatografía líquida se realizó con un espectrómetro de masas Q-Exactive plus (ThermoFisher Scientific, Waltham, MA, EUA).
Los científicos demostraron que ITIH4 es escindido por varias proteasas humanas dentro de una región susceptible a las proteasas, lo que permite que ITIH4 funcione como inhibidor de proteasas. Esto se ejemplifica por su inhibición de la serina proteasa-1 asociada a lectina de unión a manano (MASP-1), MASP-2 y calicreína plasmática, que son proteasas clave para la defensa intravascular del huésped. Mecánicamente, ITIH4 actúa como un señuelo que, tras la escisión, forma un complejo inhibidor no covalente con la proteasa ejecutora que depende del dominio del factor A de ITIH4 von Willebrand. ITIH4 inhibe las MASP impidiendo estéricamente que los sustratos de proteínas más grandes accedan a sus sitios activos, que permanecen accesibles y completamente funcionales para los sustratos pequeños.
Los autores concluyeron que los sitios activos de MASP dentro de los complejos ITIH4-MASP no covalentes son catalíticamente competentes, pero la escisión aguas abajo de C2 y C4 se inhibe bloqueando físicamente el acceso de los enlaces escindibles a los sitios activos. Tal actividad se demostró en suero humano y murino. Se encontró que ITIH4 es escindido por varias proteasas dentro de la región susceptible a proteasas (PSR), lo que sugiere que ITIH4 es un inhibidor de acción amplia dirigido contra numerosas proteasas. El estudio fue publicado el 8 de enero de 2021 en la revista Science Advances.
Enlace relacionado:
Universidad de Aarhus
ThermoFisher Scientific