Identifican gen con origen biológico de la esquizofrenia
Por el equipo editorial de LabMedica en español
Actualizado el 14 Mar 2016
Actualizado el 14 Mar 2016
En un estudio de referencia, los investigadores han identificado mutantes en el gen del componente del complemento 4 (C4) que están fuertemente asociados con el riesgo de desarrollar esquizofrenia. Ellos descubrieron además que el C4, la proteína conocida del sistema inmune, también participa en la “poda sináptica” en el cerebro. El estudio proporciona información importante sobre el origen biológico y la fisiología subyacente de esta enfermedad debilitante, y probablemente un nuevo camino para el desarrollo de pruebas diagnósticas que permitan la detección temprana, así como medicamentos más eficaces para el tratamiento y prevención al permitir que las estrategias terapéuticas puedan ser dirigidas contra las causas de la aflicción, en lugar de sus síntomas.
“Desde que la esquizofrenia fue descrita por primera vez hace más de un siglo, su biología subyacente ha sido una caja negra, en parte debido a que ha sido prácticamente imposible hacer modelos celulares o animales del trastorno”, dijo el líder del estudio, Steven McCarroll, profesor asociado de la Facultad de Medicina de Harvard y el director de genética para el Centro Stanley para la Investigación Psiquiátrica en el Instituto Broad (Cambridge, MA, EUA). “El genoma humano está proporcionando una nueva y poderosa forma para entender esta enfermedad".
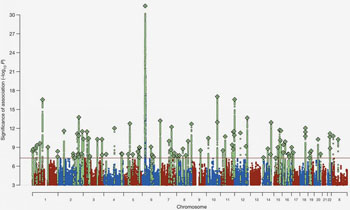
Previamente, se habían identificado más de 100 regiones en el genoma humano que portan factores de riesgo para la esquizofrenia. La señal de riesgo-asociación más fuerte estaba, de lejos, en el cromosoma 6, en una región asociada desde hace mucho tiempo con las enfermedades infecciosas, por lo que algunos sugieren que la esquizofrenia puede ser provocada por un agente infeccioso. La asociación genética más fuerte conocida de la esquizofrenia a nivel de población implica la variación en el locus del sistema inmune complejo mayor de histocompatibilidad (MHC), pero los genes y mecanismos moleculares que explican esta situación han sido difíciles de encontrar usando métodos genéticos convencionales. El nuevo estudio muestra que esta asociación se origina, en parte, de muchos diversos alelos de los genes C4. Mediante el examen de los niveles de ARN, los investigadores encontraron que estos alelos generan niveles muy diversos de expresión de C4A y C4B en el cerebro.
El estudio se basó en el estudio del ADN recolectado de más de 100.000 personas provenientes de 30 países, el análisis detallado de la variación genética compleja en más de 65.000 genomas humanos, el desarrollo de una estrategia analítica muy novedosa, el examen de muestras de cerebro post mortem de cientos de personas y el uso de animales modelos con el fin de poder estudiar, aún más, la función biológica de C4.
El análisis de los datos del genoma de casi 65.000 personas (con y sin esquizofrenia) reveló una correlación sorprendente: los pacientes que tenían alelos particulares de C4 mostraron una mayor expresión de ese alelo, así como un mayor riesgo de desarrollar esquizofrenia. Por lo tanto, las mutaciones que conducen a la expresión exagerada anormal de C4 estaban fuertemente asociadas con la predisposición a la esquizofrenia.
¿Cómo sucede que el C4, conocido por marcar los microbios infecciosos para su destrucción por las células inmunes-influye sobre el riesgo de la esquizofrenia? Los investigadores encontraron que la proteína C4 humana se localizaba en las sinapsis neuronales, dendritas, axones y cuerpos celulares. También descubrieron que C4 juega un papel clave en la poda de las sinapsis durante la maduración del cerebro. En particular, C4 era necesario para que se depositara el componente del complemento 3 (C3) sobre las sinapsis, como una etiqueta que indica que esas sinapsis deben ser podados. Los datos también sugieren que una mayor actividad de C4 se asocia con el aumento de la eliminación de las sinapsis cerebrales en un momento clave en el desarrollo del cerebro. En los ratones, el C4 media la eliminación de sinapsis durante el desarrollo postnatal.
El cerebro humano normalmente pasa por una poda generalizada de las sinapsis (especialmente en la corteza cerebral) durante la adolescencia, el período típico en que aparecen los síntomas iniciales. “Normalmente, la poda se deshace de las conexiones excesivas, que ya no son necesarias, agilizando a nuestro cerebro para que pueda tener un desempeño óptimo, pero el exceso de poda puede deteriorar la función mental”, explicó Thomas Lehner, PhD, director de la Oficina de Coordinación de Investigaciones en Genómica del Instituto Nacional de Salud Mental de los NIH (NIMH, Bethesda, MD, EUA). “Este fenómeno podría ayudar a explicar la edad tardía de aparición de los síntomas de la esquizofrenia en la adolescencia tardía/edad adulta temprana y la contracción del tejido de trabajo del cerebro. “Los resultados también pueden ayudar a explicar el antiguo misterio de por qué los cerebros de las personas con esquizofrenia tienden a tener una corteza cerebral más delgada con un menor número de sinapsis que las personas no afectadas.
Los resultados revelaron que la poda excesiva de conexiones de sinapsis cerebrales predispone a la esquizofrenia. El hecho afortunado de que ya se sabe mucho sobre el papel de C4 y otras proteínas del complemento en el sistema inmune significa que los investigadores pueden tener acceso a una gran cantidad de conocimiento existente para identificar posibles métodos terapéuticos. Por ejemplo, ya están en fase de desarrollo los medicamentos anti-complemento para el tratamiento de otras enfermedades.
“A pesar de que aún es pronto, hemos visto el poder de comprender el mecanismo biológico de la enfermedad en otras situaciones”, dijo Eric Lander, director del Instituto Broad, “La comprensión de la esquizofrenia acelerará, similarmente, el progreso contra esta enfermedad devastadora que afecta a las personas jóvenes”.
La realización de este trabajo fue posible, en gran parte, por la financiación catalítica del Centro Stanley y el artículo fue dedicado al fallecido Ted Stanley. “A través de la filantropía, hemos sido capaces de hacer apuestas y hacer investigaciones en ciencia arriesgada con resultados potencialmente transformadores”, dijo el director del Centro Stanley, Steven Hyman, “Con el apoyo del fallecido Ted y de Vada Stanley, los científicos generales tienen la libertad de reunir a las personas, capacidades, y recursos en formas muy novedosas”.
“Este estudio marca un punto de inflexión crucial en la lucha contra las enfermedades mentales. Cambia el juego”, agregó Bruce Cuthbert, PhD, director interino del NIMH. “Gracias a este avance genético por fin podemos ver el potencial de las pruebas clínicas: la detección temprana, los nuevos tratamientos, e incluso la prevención”.
El estudio, realizado por Sekar A et al., Fue publicado en línea antes de impresión, el 27 de noviembre de 2016, en la revista Nature.
Enlaces relacionados: