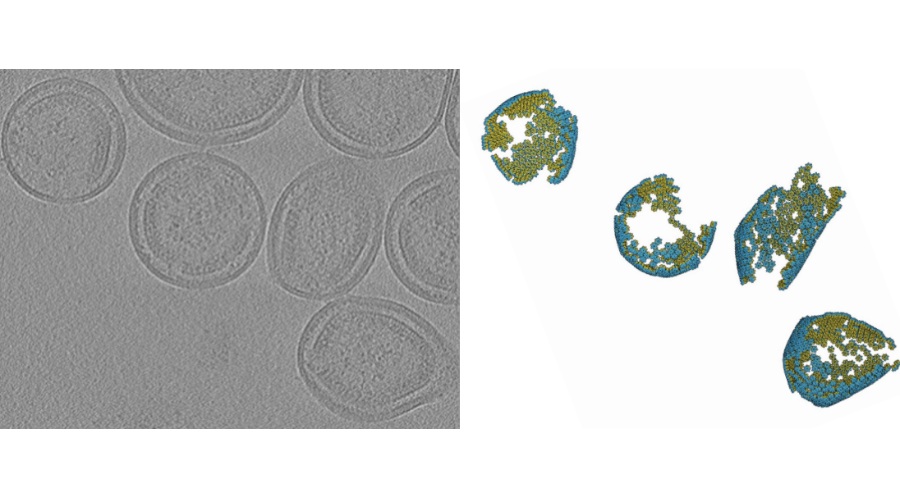
Secuenciación de una sola célula identifica el riesgo de cáncer de mama
Por el equipo editorial de LabMedica en español
Actualizado el 12 Feb 2020
Las mujeres que albergan mutaciones de BRCA2 en la línea germinal heterocigota tienen un riesgo del 50% al 80% de desarrollar cáncer de mama, aunque la patogénesis de estos cánceres es poco conocida. Los cánceres de seno que surgen en mujeres que heredan mutaciones heterocigotas en BRCA2 están asociados con una alta prevalencia de alteraciones genómicas y un comportamiento clínico agresivo.Actualizado el 12 Feb 2020
Debido al alto riesgo de estos cánceres en los portadores de la mutación BRCA2, muchas de estas mujeres prefieren que les realicen una mastectomía bilateral para la prevención del cáncer de seno. Sin embargo, a pesar de la necesidad insatisfecha de métodos de prevención del cáncer de mama más efectivos en este contexto, no se ha podido definir la evolución gradual de una célula mutante heterocigótica BRCA2 (BRCA2mut/+) a una neoplasia maligna invasiva.
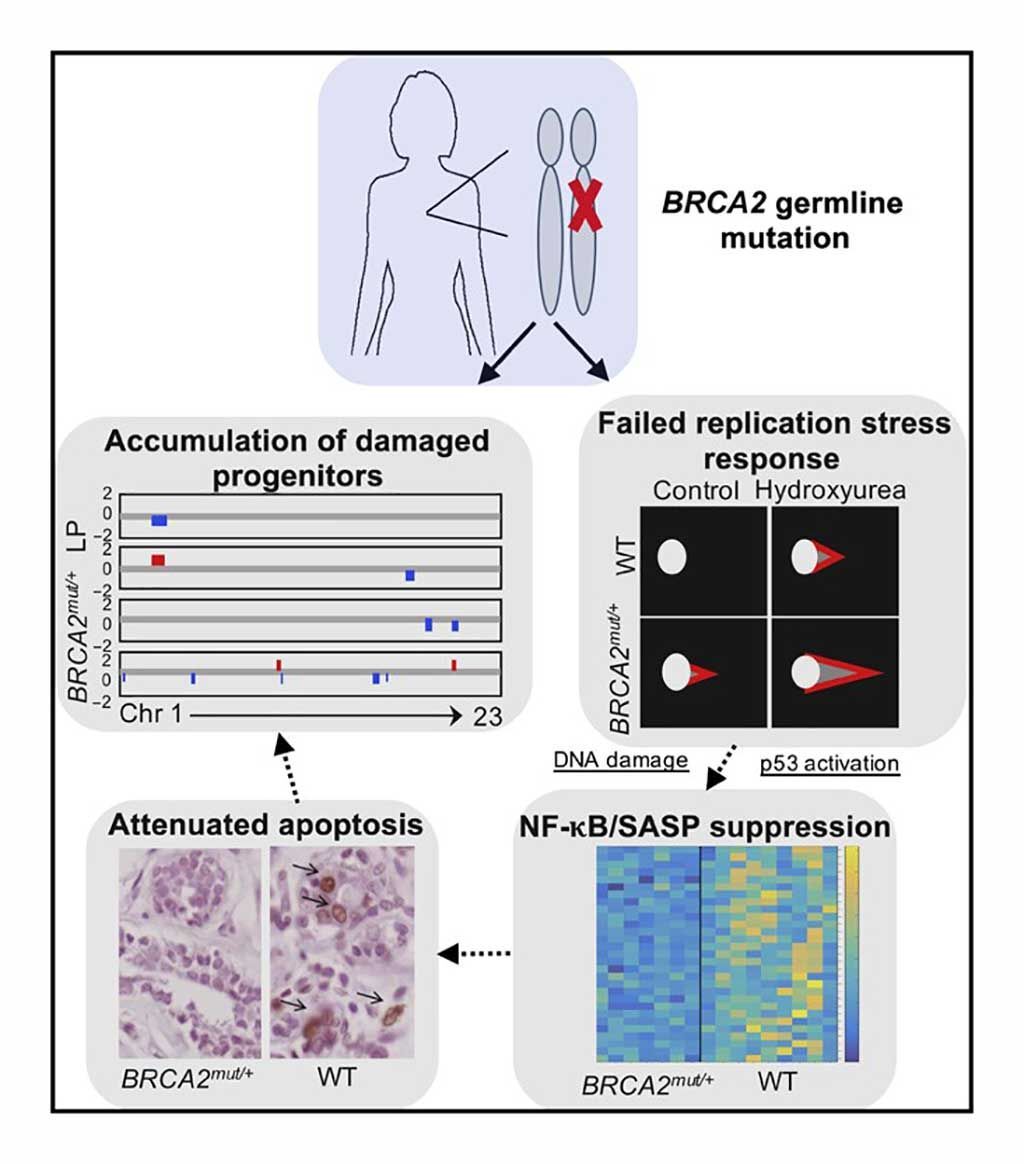
Imagen: Resumen de los hallazgos en tejidos primarios de mama BRCA2mut/+: las células epiteliales progenitoras de portadoras de BRCA2 de línea germinal heterocigótica exhiben daño en el ADN, estrés de replicación fallido y respuestas al daño, junto con apoptosis atenuada. Los análisis de pérdida de heterocigosidad (LOH) sugieren que estos hallazgos pueden reflejar un fenotipo haploinsuficiente para el BRCA2 in vivo (Fotografía cortesía del Hospital General de Massachusetts).
Científicos médicos del Hospital General de Massachusetts (Boston, MA, EUA) realizaron una secuenciación de genoma completo de una sola célula en poblaciones celulares clasificadas a partir de muestras de tejido mamario de más de dos docenas de mujeres con mutación BRCA2 positiva, que se habían sometido a mastectomías profilácticas bilaterales. Las participantes solo tenían una copia afectada del gen relacionado con el cáncer de mama y ovario.
Los equipos compararon los perfiles genéticos en estas poblaciones de células de mama con los de individuos de control pareados, y pudieron rastrear alteraciones que estaban representadas exageradamente en las células deficientes en BRCA2. Por ejemplo, con este método, descubrieron aneuploidía subcromosómica en más de una cuarta parte de las células progenitoras luminales de portadores de mutaciones BRCA2. Mientras tanto, en las células epiteliales de la mama, los cambios heterocigotos de BRCA2 coincidieron con un salto en el daño del ADN, junto con una reducción de la vía apoptótica o de la actividad de replicación del punto de control.
Los investigadores se centraron en las portadoras de mutación BRCA2 heterocigotas que no tenían cáncer de mama y no habían estado expuestas previamente a la quimioterapia, junto con pacientes de control que coincidían con factores que iban desde la edad hasta la exposición a hormonas y el estado de la menopausia, que donaron muestras de tejido mamario después de cirugías electivas de reducción mamaria. Con la ayuda de la citometría de flujo basada en marcadores celulares, usando un citómetro de flujo FACSAria (Becton Dickinson, Franklin Lakes, NJ, EUA), el equipo pudo diferenciar entre poblaciones de células maduras luminales, luminales progenitoras y epiteliales basales en la muestras de tejido de mama de participantes con o sin mutaciones BRCA2.
Los científicos utilizaron la secuenciación del genoma unicelular y los análisis algorítmicos para identificar cambios en el número de copias y otras alteraciones somáticas en cada tipo de células, identificando patrones compatibles con la secuenciación de ARN, la reacción en cadena de la polimerasa unicelular (PCR) y otros análisis de seguimiento. En muestras de 26 mujeres con mutaciones BRCA2 y 28 sin ellas, también vieron una expansión aparente en la proporción de células progenitoras luminales con estrés reducido y respuesta al daño del ADN en muestras de portadores de mutaciones BRCA2 envejecidas.
Los autores concluyeron que, aunque los primeros cambios genómicos que observaron probablemente incluirían muchos eventos pasajeros estos, sin embargo, pueden proporcionar un sello distintivo cuantificable del estado portador preneoplásico de BRCA2. El seguimiento de la prevalencia de las células dañadas por el ADN en el entorno clínico podría mejorar la predicción del riesgo para estas mujeres, que enfrentan la difícil elección de que les practiquen una mastectomía mucho antes de que se desarrolle el cáncer. El estudio fue publicado el 29 de enero de 2020 en la revista Science Advances.
Enlace relacionado:
Hospital General de Massachusetts
Becton Dickinson