Identifican citoquinas objetivo para el tratamiento de la hemofilia A resistente
Por el equipo editorial de LabMedica en español
Actualizado el 03 May 2021
La hemofilia A, también llamada deficiencia del factor VIII (8) o hemofilia clásica, es un trastorno genético causado por la falta o defecto del factor VIII (FVIII), una proteína de la coagulación. Aunque se transmite de padres a hijos, aproximadamente 1/3 de los casos encontrados no tienen antecedentes familiares previos.Actualizado el 03 May 2021
Actualmente, la hemofilia es el trastorno hemorrágico hereditario más común, que afecta a 1 de cada 10.000 hombres en todo el mundo. Dado que los pacientes carecen del factor de coagulación VIII (FVIII), las terapias suelen estar dirigidas a las infusiones para reemplazar la proteína faltante. Sin embargo, algunos pacientes se vuelven resistentes al tratamiento debido al desarrollo de anticuerpos neutralizantes o inhibidores del FVIII.
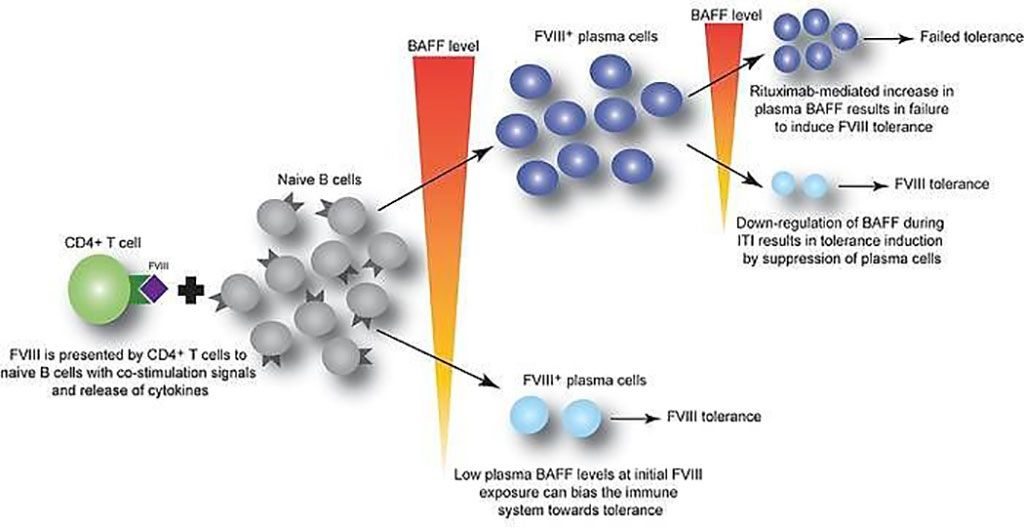
Imagen: El factor activador de células B modula la respuesta inmune del factor VIII en la hemofilia A (Fotografía cortesía del Hospital Infantil de Filadelfia)
Un equipo internacional de hematólogos y sus asociados dirigido por los del Hospital Infantil de Filadelfia (Filadelfia, PA, EUA), utilizó muestras de plasma de 69 pacientes pediátricos que recibían terapia con FVIII recombinante, además de muestras de modelos de ratón, para determinar si el factor de activación de células B de citoquinas (BAFF) puede ayudar a generar y mantener anticuerpos contra el FVIII. De los pacientes pediátricos, 24 tenían inhibidores de FVIII.
Los niveles de BAFF, ligando inductor de proliferación (APRIL) y antígeno de maduración de células B (BCMA) de las muestras de pacientes se midieron mediante un ELISA multiplex. Debido a las limitaciones en el transporte de muestras, los niveles de BAFF de pacientes expuestos a rituximab se midieron mediante ELISA (R&D Systems, Minneapolis, MN, EUA). La frecuencia de células B secretoras de inmunoglobulina específicas de FVIII se cuantificó mediante un ensayo ELISPOT de células B. Las placas se analizaron con el sistema ImmunoSpot (Cellular Technology Limited, Shaker Heights, OH, EUA).
El equipo informó que los niveles de BAFF eran más altos en pacientes con inhibidores persistentes de FVIII, en comparación con aquellos sin inhibidores (1,30 versus 0,99 ng/mL, respectivamente). Además, los niveles de BAFF disminuyeron desde el inicio en pacientes con inhibidor de la hemofilia A quienes les realizaron la inducción de tolerancia inmunitaria (ITI) y lograron tolerancia al FVIII de 1,43 ± 0,63 a 0,81 ± 0,32 ng/mL. En comparación, aquellos que fracasaron en la ITI tenían niveles estables de 1,33 a 1,23 ng/mL. También se observó un patrón y una tendencia similares en los niveles de BAFF para 46 adultos, aunque los pacientes sin inhibidores vieron un nivel generalmente más alto de BAFF. Además, un análisis de las características operativas del receptor (ROC) de los datos combinados de niños y adultos, mostró que los niveles de BAFF superiores a 1,03 ng/mL tenían una sensibilidad del 68,3%, una especificidad del 63,8% y un índice de probabilidad de 1,89 para la presencia de inhibidores del FVIII.
Valder R. Arruda, MD, PhD, hematólogo y autor principal del estudio, dijo: “Nuestros datos sugieren que BAFF puede regular la generación y mantenimiento de inhibidores del FVIII, así como de células B anti-FVIII. Dado que actualmente se usa un anticuerpo anti-BAFF aprobado por la FDA para suprimir la respuesta inmune en enfermedades autoinmunes, los estudios futuros deberían explorar el uso de este tratamiento en combinación con el rituximab para lograr mejores resultados en pacientes con hemofilia A resistentes a la terapia de reemplazo de la proteína FVIII”.
Los autores concluyeron que sus datos sugieren que BAFF puede regular la generación y el mantenimiento de inhibidores del FVIII y/o células B anti-FVIII. Finalmente, la terapia de combinación antiCD20/anti-BAFF puede ser clínicamente útil para la ITI. El estudio fue publicado el 15 de abril de 2021 en la revista The Journal of Clinical Investigation.
Enlace relacionado:
Hospital Infantil de Filadelfia
R&D Systems
Cellular Technology Limited