Metabolismo del triptófano está mal regulado en los individuos con anemia de Fanconi
Por el equipo editorial de LabMedica en español
Actualizado el 20 Jan 2021
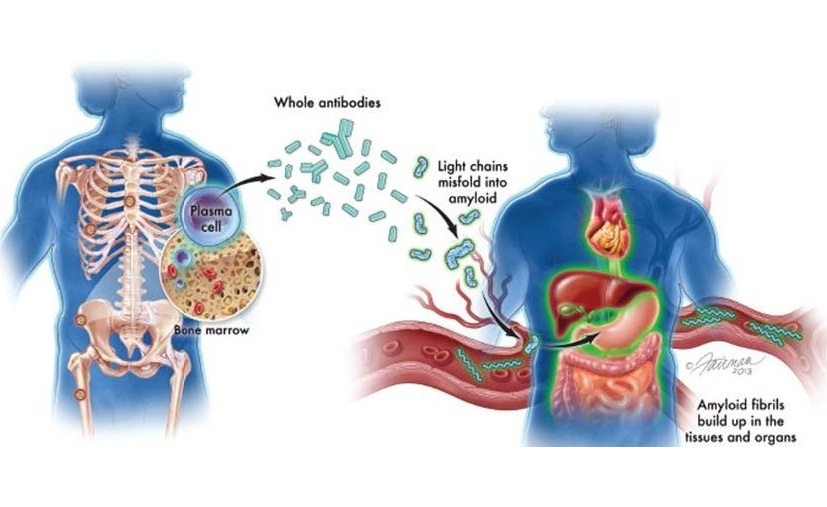
La anemia de Fanconi (AF) es un trastorno genético complejo que se asocia frecuentemente con insuficiencia medular progresiva y una fuerte predisposición a neoplasias malignas tempranas, en particular carcinomas escamocelulares y carcinomas hepatocelulares.Actualizado el 20 Jan 2021
El triptófano es un aminoácido esencial necesario para la síntesis de proteínas. El metabolismo del triptófano se ha relacionado estrechamente con alteraciones en el microbioma, y la mala regulación de la vía del triptófano tiene implicaciones significativas para la regulación inmunológica del huésped, la inflamación intestinal y la salud en general.
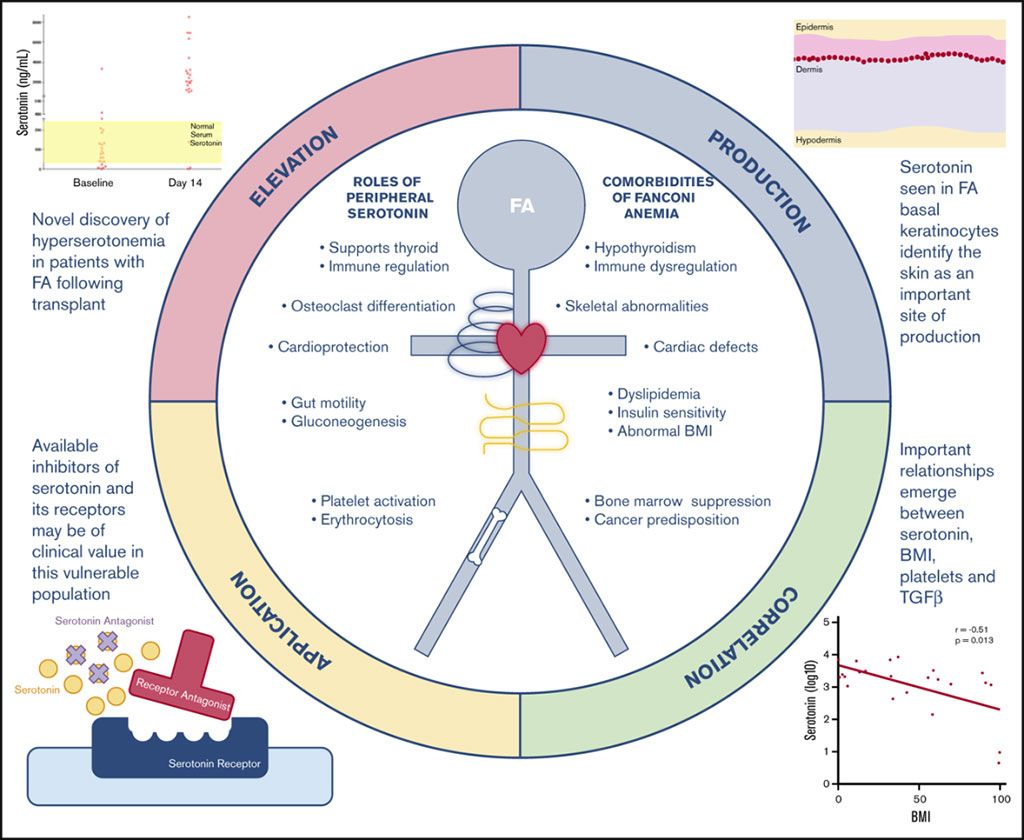
Imagen: El metabolismo del triptófano está mal regulado en personas con anemia de Fanconi (Fotografía cortesía del Centro Médico del Hospital Infantil de Cincinnati).
Los hematólogos del Centro Médico del Hospital Infantil de Cincinnati (Cincinnati, OH, EUA) y sus asociados, recolectaron muestras de sangre y heces de 23 pacientes con AF (52% mujeres y rango de edad de 5 a 27 años) y 29 pacientes con otros diagnósticos (31% mujeres y rango de edad 1-18 años). El equipo estudió el metabolismo del triptófano en la AF examinando el triptófano y sus metabolitos antes y durante el estrés del trasplante de células madre hematopoyéticas (TCMH). El triptófano se puede convertir en serotonina y quinurenina.
Los niveles plasmáticos de triptófano y de sus metabolitos se midieron utilizando un ensayo inmunoabsorbente ligado a enzimas (ELISA): triptófano (Abnova, Taipéi, Taiwán); serotonina y melatonina (Enzo, Farmingdale, NY, EUA); quinurenina (BlueGene Biotech, Shanghái, China); factor de crecimiento transformante β1 (TGF-β1, R&D Systems, Minneapolis, MN, EUA).
Se aisló el ARN total de células mononucleares de sangre periférica (PBMC) y se midió la expresión de indolamina 2,3-dioxigenasa, triptófano hidroxilasa 1 y transportador de serotonina, mediante RT-qPCR en un sistema de PCR en tiempo real 7300 de Applied Biosystems (Thermo Fisher Scientific, Waltham, MA, EUA). El equipo también realizó inmunoquímica usando un microscopio Olympus BX53 (Olympus América, Waltham, MA, EUA). También se realizó análisis con resonancia magnética nuclear en las muestras de plasma.
Los científicos informaron que los niveles de serotonina estaban marcadamente elevados 14 días después del TCMH en individuos con AF, en contraste con los individuos sin AF. Los niveles de quinurenina se redujeron significativamente en los individuos con AF, en comparación con los individuos sin AF, antes y después del TCMH. La mayor parte de la serotonina periférica se produce en el intestino. Sin embargo, los niveles de serotonina en las heces disminuyeron en las personas con AF después del trasplante, de manera similar a las personas sin AF. En cambio, el equipo detectó la producción de serotonina en la piel en personas con AF, mientras que no se observó ninguna producción en personas sin AF.
Los niveles de serotonina y TGF-β se correlacionaron estrechamente con el recuento de plaquetas antes y después del TCMH en personas sin AF. En la AF, ni la serotonina basal ni el TGF-β se correlacionaron con el recuento basal de plaquetas (plaquetas derivadas del huésped), solo el TGF-β se correlacionó 14 días después del trasplante (plaquetas derivadas del banco de sangre).
Los autores concluyeron que sus hallazgos sugieren que la inhibición de la serotonina es una nueva vía para disminuir una multitud de riesgos clínicos y fenotipos de enfermedades en la AF, que ahora requerirán una caracterización detallada del metabolismo de la serotonina local y sistémica. El estudio fue publicado el 7 de enero de 2021 en la revista Blood Advances.
Enlace relacionado:
Centro Médico del Hospital Infantil de Cincinnati
Abnova
Enzo
BlueGene Biotech
R&D Systems
Olympus America