Recomiendan análisis de muestras mezcladas para cribado del Zika
Por el equipo editorial de LabMedica en español
Actualizado el 09 Aug 2018
La Administración de Medicamentos y Alimentos de los Estados Unidos (Silver Springs, MD, EUA) dijo hoy que ha revisado sus recomendaciones para evaluar las donaciones de sangre para el virus del Zika. En una guía final revisada, la agencia dijo que las pruebas de donaciones mezcladas usando una prueba de detección que ha sido autorizada son un método suficiente para cumplir con las normas de análisis y reducir efectivamente el riesgo de transmisión del virus del Zika.Actualizado el 09 Aug 2018
El nuevo enfoque suele ser más rentable y menos oneroso para los centros de transfusión sanguínea, y la FDA continuará monitorizando de cerca la situación, y según corresponda, reconsiderará qué medidas se necesitan para mantener la seguridad del suministro de sangre. La guía revisada reemplaza una guía anunciada en agosto de 2016 que recomendaba la prueba universal de ácido nucleico para el virus del Zika de las unidades individuales de sangre donadas en los estados y territorios de los EUA
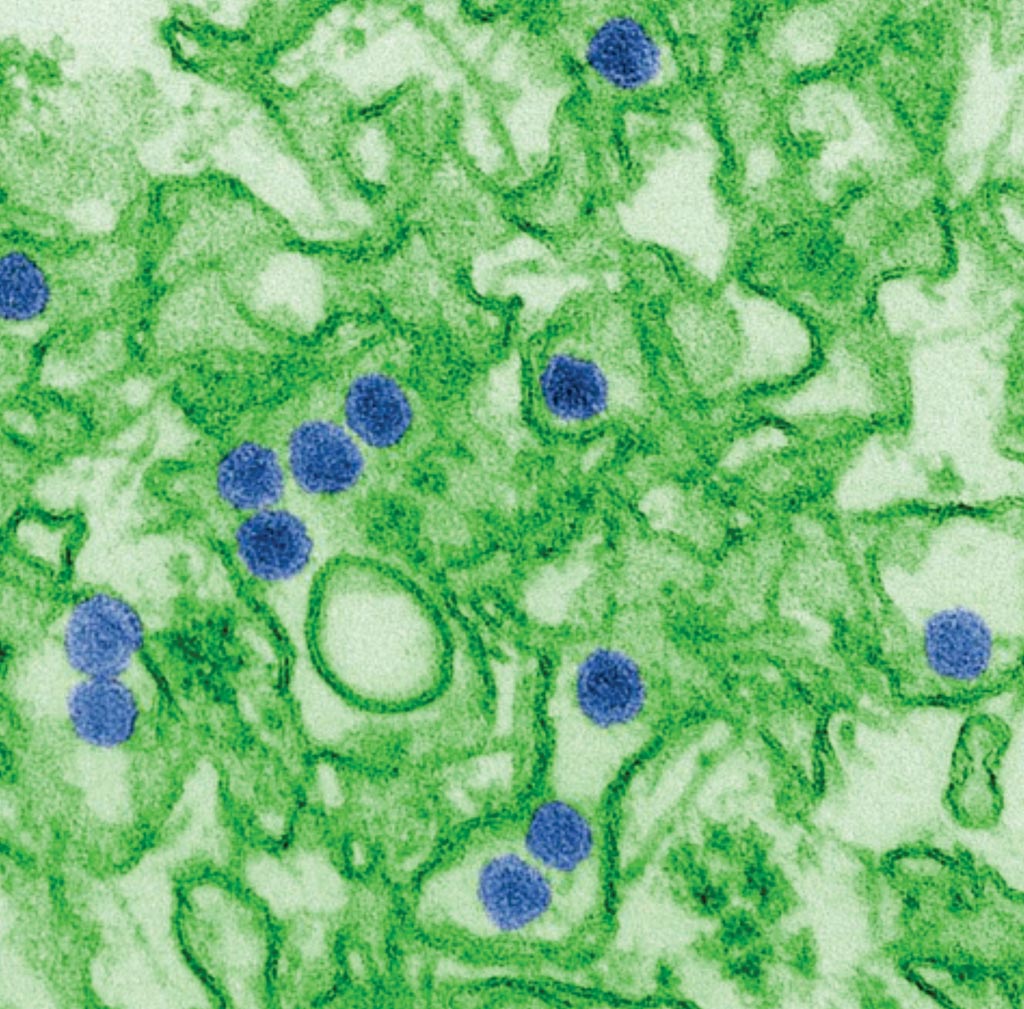
Imagen: Una imagen de microscopía electrónica de transmisión (TEM) coloreada digitalmente del virus Zika, que es un miembro de la familia, Flaviviridae. Las partículas de virus, aquí de color azul, tienen un diámetro de 40 nm, con una envoltura exterior y un núcleo interno denso (Fotografía cortesía de Cynthia Goldsmith).
Después de los brotes del virus del Zika, los hemocentros de los EUA comenzaron, en 2016, a implementar la prueba de ácido nucleico para cada donación individual en nuevas aplicaciones de fármacos en investigación. Utilizaron los análisis Roche Cobas (Roche Molecular Diagnostics, Pleasanton, CA, EUA) o el Grifols Procleix Zika virus (Grifols, Barcelona, España). En mayo de este año, la FDA aprobó una aseveración adicional para la prueba Cobas Zika de Roche para su uso en los sistemas de PCR Cobas 6800 y 8800 que permite el cribado simplificado de múltiples donaciones individuales de sangre o plasma que se han mezclado. La prueba Cobas Zika es una prueba cualitativa in vitro de detección de ácido nucleico para la detección directa del ARN del virus del Zika en muestras de plasma de donantes de sangre humanos individuales. Permite que los servicios de sangre garanticen que las unidades de sangre potencialmente infectadas no estén disponibles para la transfusión.
En una excepción a las pruebas agrupadas en su guía revisada, la FDA dijo que un mayor riesgo de transmisión del virus del Zika a través del mosquito local en un área geográfica específica requeriría pruebas de donación individual en ese lugar. El cambio general, anunciado en un documento de orientación revisado, titulado Recomendaciones Revisadas para Reducir el Riesgo de Transmisión del Virus Zika por la Sangre y los Componentes Sanguíneos, viene después de una cuidadosa consideración de toda la evidencia científica disponible, incluida la consulta con otras agencias de salud pública, y sigue las recomendaciones de una reunión de diciembre de 2017 del Comité Asesor de Productos Sanguíneos.