Biosensor electroquímico basado en CRISPR detecta microARN relacionados con la enfermedad
Por el equipo editorial de LabMedica en español
Actualizado el 11 Dec 2019
Se ha introducido un chip microfluídico que contiene un biosensor electroquímico basado en CRISPR/Cas como un dispositivo para el análisis rápido y preciso de los microARN involucrados en varios estados de enfermedad.Actualizado el 11 Dec 2019
Los microARN (miARN) y los ARN interferentes cortos (siARN) comprenden una clase de fragmentos de ARN de aproximadamente 20 nucleótidos de longitud, que bloquean la expresión génica al unirse a las moléculas del ARN mensajero de una manera tal que les impide transmitir las instrucciones de síntesis de proteínas que habían recibido del ADN. Con su capacidad para ajustar la expresión de proteínas mediante interacciones específicas de secuencia, los miARN ayudan a regular el mantenimiento y la diferenciación celular. Además de que los miARN desempeñan un papel esencial en el desarrollo de tumores, se ha asociado la mala regulación de ciertos miARN con muchas enfermedades diferentes, como la demencia y las enfermedades cardiovasculares.

Imagen: Los investigadores presentaron el primer biosensor electroquímico basado en CRISPR para ayudar a mejorar el diagnóstico de las enfermedades (Fotografía cortesía de Richard Bruch, Universidad de Friburgo)
Los CRISPR (repeticiones palindrómicas cortas agrupadas regularmente y separadas entre sí) son segmentos de ADN procariótico que contienen repeticiones cortas de secuencias de bases. Cada repetición es seguida por segmentos cortos de “ADN espaciador” de exposiciones previas a un virus o plásmido bacteriano. Desde 2013, se ha utilizado el sistema CRISPR/Cas9 en la investigación para la edición de genes (agregar, interrumpir o cambiar la secuencia de genes específicos) y la regulación de genes. Al administrar la enzima Cas9 y los ARN guía apropiados (sgARN) en una célula, el genoma del organismo se puede cortar en cualquier lugar deseado. El sistema convencional CRISPR/Cas9 de Streptococcus pyogenes se compone de dos partes: la enzima Cas9, que escinde la molécula de ADN y las guías de ARN específicas que guían la proteína Cas9 al gen objetivo en una cadena de ADN.
Los esfuerzos computacionales recientes para identificar nuevos sistemas CRISPR descubrieron un nuevo tipo de enzima dirigida al ARN, Cas13. La diversa familia Cas13 contiene al menos cuatro subtipos conocidos, incluidos Cas13a (anteriormente C2c2), Cas13b, Cas13c y Cas13d. Se demostró que Cas13a se une y escinde ARN, protegiendo a las bacterias de los fagos de ARN y sirviendo como una plataforma poderosa para la manipulación de ARN. Se sugirió que Cas13a podría funcionar como parte de un sistema CRISPR/Cas versátil, dirigido a ARN guiado por ARN y que tiene un gran potencial para aplicaciones precisas, robustas y escalables de orientación a ARN guiado por ARN.
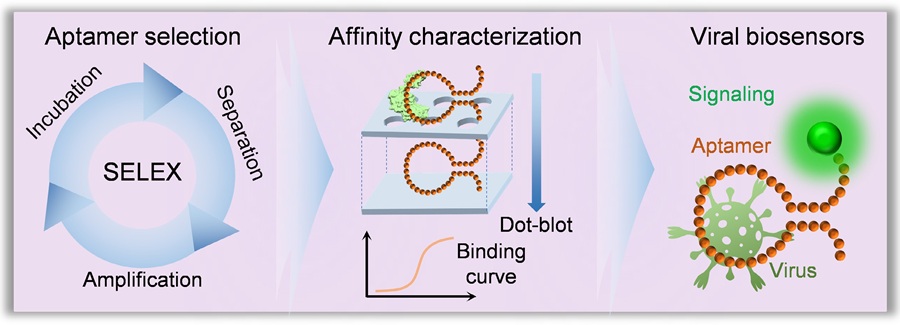
Los investigadores de la Universidad de Friburgo (Alemania) explotaron las características de Cas13a al usarlo para alimentar un biosensor electroquímico integrado microfluídico para la detección in situ de microARN. Se colocó una muestra de suero que contenía ARN en el sensor. Si contenía el ARN objetivo, esta molécula se combinaba con un complejo proteico en la solución y activaba la enzima de escisión Cas. Después de la activación, la enzima escindió los ARN informadores que estaban unidos a las moléculas de señalización, generando una corriente eléctrica, que se midió electroquímicamente. Este cambio indicó si el miARN objetivo estaba presente en la muestra o no. Si el microARN objetivo no estaba presente, no se generó corriente.
Los investigadores mostraron que al emplear esta combinación única de agentes, se logró la cuantificación de los posibles marcadores tumorales de microARN miR ‐ 19b y miR ‐ 20a sin necesidad de amplificación de ácido nucleico. El sistema requirió menos de 0,6 microlitros de muestra, tuvo un tiempo de lectura de nueve minutos y un tiempo de proceso general de menos de cuatro horas. Además, se demostró la viabilidad de la plataforma de biosensores para detectar miR ‐ 19b en muestras de suero de niños que padecen cáncer cerebral.
“Nuestro biosensor electroquímico es cinco a 10 veces más sensible que otras aplicaciones que usan CRISPR/Cas para el análisis de ARN”, dijo el autor colaborador, Dr. Can Dincer, líder del grupo de investigación en el departamento de ingeniería de microsistemas de la Universidad de Friburgo. “Lo especial de nuestro sistema es que funciona sin necesidad de replicación de miARN, porque en ese caso, se requerirían dispositivos y productos químicos especializados. Eso hace que nuestro sistema sea de bajo costo y considerablemente más rápido que otras técnicas o métodos”.
El biosensor basado en CRISPR se describió en la edición en línea del 30 de octubre de 2019 de la revista Advanced Materials.
Enlace relacionado:
Universidad de Friburgo







 Analyzer.jpg)