Sistema de nanopartículas captura un biomarcador de la enfermedad cardiaca a partir de sangre
Por el equipo editorial de LabMedica en español
Actualizado el 19 Aug 2020
Actualmente, los médicos utilizan una prueba basada en anticuerpos llamada ensayo inmunoabsorbente ligado a enzimas (ELISA) para ayudar a diagnosticar ataques cardíacos basándose en niveles elevados de troponina I cardíaca (cTnI) en la muestra de sangre de los pacientes. Si bien la prueba ELISA es sensible, los pacientes pueden tener niveles altos de cTnI en la sangre sin que tengan una enfermedad cardíaca, lo que puede conducir a tratamientos costosos e innecesarios para ellos.Actualizado el 19 Aug 2020
La medición de proteínas de baja concentración en la sangre como la cTnI es un problema clásico de buscar una aguja en un pajar. Los biomarcadores raros y significativos de enfermedades están completamente abrumados por proteínas comunes y poco prácticas para el diagnóstico en la sangre. Los métodos actuales utilizan anticuerpos para enriquecer y capturar proteínas en una muestra compleja para identificar y cuantificar proteínas. Pero los anticuerpos son costosos, tienen variaciones de lote a lote y pueden generar resultados inconsistentes.

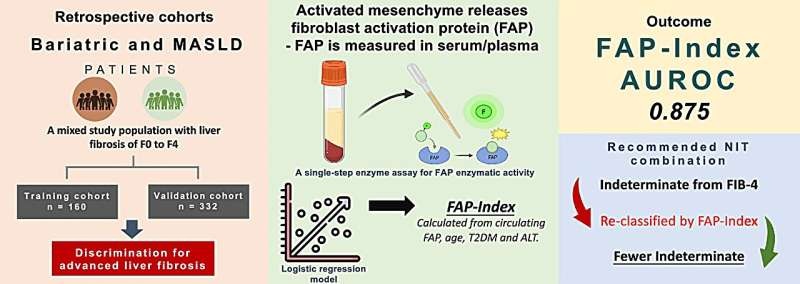
Imagen: El TriVersa NanoMate LESA utiliza tecnología de ionización por electrodispersión basada en chips que combina los beneficios de la cromatografía líquida, la espectrometría de masas, la infusión basada en chips, la recolección de fracciones y el análisis directo de superficie en una plataforma de fuente de iones integrada (Fotografía cortesía de Advion BioSciences).
Los químicos de la Universidad de Wisconsin-Madison (Madison, WI, EUA) diseñaron nanopartículas de magnetita, una forma magnética de óxido de hierro, y la vincularon a un péptido de 13 aminoácidos de largo diseñado para unirse específicamente a la cTnI. El péptido se adhiere a la cTnI en una muestra de sangre, y las nanopartículas se pueden recolectar juntas usando un imán. Las nanopartículas y los péptidos se fabrican fácilmente en el laboratorio, lo que los hace baratos y consistentes.
El equipo, mediante el uso de nanopartículas, pudo enriquecer eficazmente cTnI en muestras de sangre y tejido cardíaco humano. Luego utilizaron espectrometría de masas avanzada, que puede distinguir diferentes proteínas por su masa, no solo para obtener una medición exacta de cTnI, sino también para evaluar las diversas formas modificadas de la proteína. Las muestras se analizaron por infusión directa mediante un sistema TriVersa NanoMate (Advion BioSciences, Ithaca, NY, EUA) acoplado a un espectrómetro de masas de resonancia ciclotrónica de iones con transformada de Fourier, solariX XR, de 12 Tesla (FTICR-MS, Bruker Daltonics, Bremen, Alemania).
Como muchas proteínas, el cuerpo puede modificar la cTnI, dependiendo de factores como una enfermedad subyacente o cambios en el medio ambiente. En el caso de cTnI, el cuerpo agrega varios números de grupos fosfato, pequeñas etiquetas moleculares que pueden cambiar la función de cTnI. Estas variaciones son sutiles y difíciles de rastrear.
Ying Ge, PhD, profesor de química y autor principal del estudio, dijo: “Por eso, queremos usar nuestro sistema nanoproteómico para analizar más detalles de varias formas modificadas de esta proteína en lugar de simplemente medir su concentración. Eso ayudará a revelar huellas digitales moleculares de cTnI de cada paciente para la medicina de precisión. Con la espectrometría de masas de alta resolución, ahora podemos ‘ver’ estos detalles moleculares de las proteínas, como el iceberg oculto debajo de la superficie”. El estudio fue publicado el 6 de agosto de 2020 en la revista Nature Communications.
Enlace relacionado:
Universidad de Wisconsin-Madison
Advion BioSciences
Bruker Daltonics