Tecnología discrimina entre la enfermedad de Parkinson y la atrofia multisistémica
Por el equipo editorial de LabMedica en español
Actualizado el 17 Feb 2020
Es difícil diferenciar entre la enfermedad de Parkinson y la atrofia multisistémica (MSA) porque los primeros signos son similares; trastornos en el movimiento, temblores, movimientos incontrolables durante el sueño, problemas del habla, pero las enfermedades progresan de manera diferente y pueden requerir planes de tratamiento distintos.Actualizado el 17 Feb 2020
La enfermedad de Parkinson (EP) provoca temblores, rigidez y dificultades con el equilibrio y el movimiento, así como una serie de síntomas no motores. La MSA conduce a un deterioro motor similar, y también a una disfunción más temprana y más severa del sistema nervioso autónomo, que controla acciones involuntarias como la presión arterial, la digestión y la micción. La MSA progresa más rápido y al principio a menudo se confunde con la EP. Ambas enfermedades se caracterizan por depósitos de una proteína conocida como alfa-sinucleína (aSyn) en el sistema nervioso.
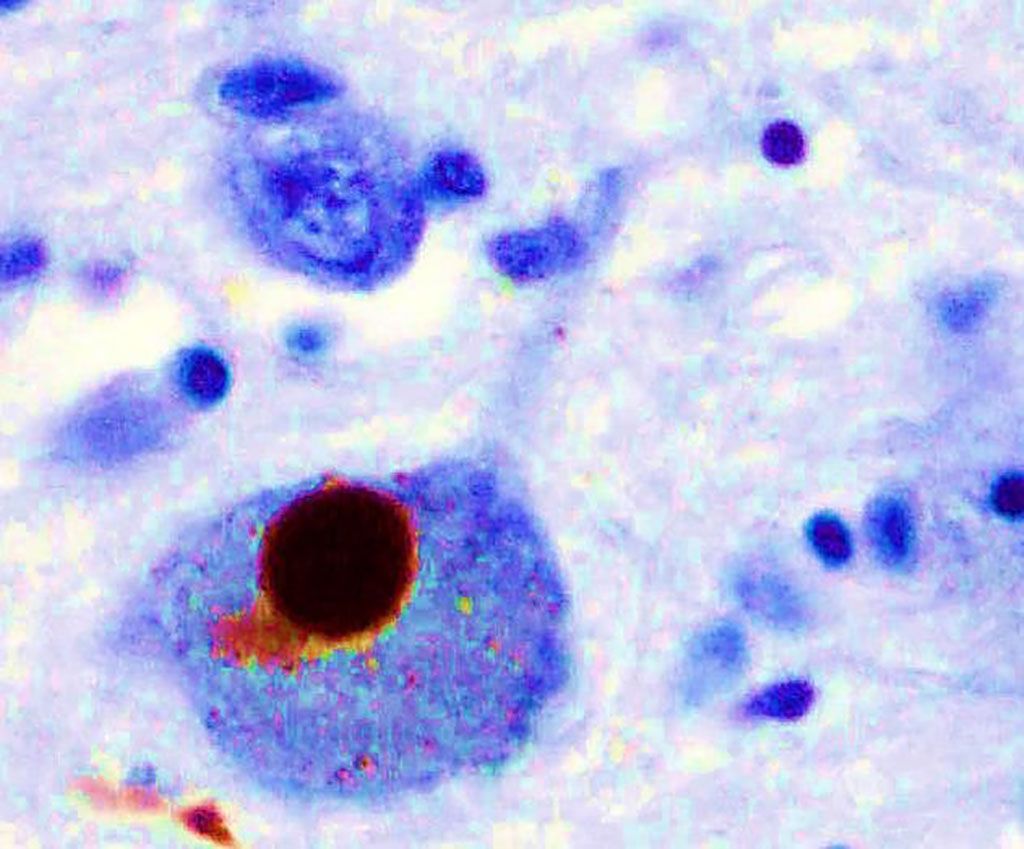
Imagen: Inmunohistoquímica para la alfa-sinucleína que muestra la coloración positiva (marrón) de un cuerpo de Lewy intraneural en la sustancia negra en la enfermedad de Parkinson (Fotografía cortesía de Marvin101).
Un equipo de científicos de diferentes instituciones y dirigido por aquellos en la Facultad de Medicina McGovern de la Universidad de Texas en Houston (Houston, TX, EUA) utilizó la tecnología de Amplificación Cíclica de Plegamiento de Proteínas (PMCA) que había mostrado, en estudios previos, la capacidad para detectar proteínas mal plegadas asociadas con enfermedades como la de Creutzfeldt-Jakob y la enfermedad de Alzheimer. Los investigadores apuntaron a los agregados aSyn mal plegados como una forma de desarrollar un diagnóstico bioquímico sensible para la EP. El equipo puso una pequeña cantidad de las proteínas en cuestión del líquido cefalorraquídeo del paciente junto con proteínas normales y observó para ver si y cómo convertían las proteínas normales.
Los científicos utilizaron una combinación de métodos bioquímicos, biofísicos y biológicos para analizar el producto de la α-sinucleína-PMCA, y descubrieron que las características de los agregados de α-sinucleína en el líquido cefalorraquídeo se podrían usar para diferenciar fácilmente entre la enfermedad de Parkinson y la atrofia multisistémica. También descubrieron que las propiedades de los agregados que se amplificaron desde el líquido cefalorraquídeo eran similares a las de los agregados que se amplificaron a partir del cerebro.
Estos hallazgos sugieren que los agregados de α-sinucleína que están asociados con la enfermedad de Parkinson y la atrofia del sistema múltiple corresponden a diferentes cepas conformacionales de α-sinucleína, que se pueden amplificar y detectar mediante α-sinucleína-PMCA. El aSyn-PMCA puede discriminar con éxito entre la EP y la ASM con una sensibilidad general del 95,4%, lo que podría permitir a los médicos mirar hacia el futuro para ver qué enfermedad necesitan abordar. El estudio también ayuda a comprender la base de estas enfermedades a nivel molecular.
Claudio Soto, PhD, profesor de neurología y autor principal del estudio, dijo: “Nuestro último estudio muestra que los agregados aSyn en la EP y la MSA tienen diferentes propiedades, por lo que al amplificar los agregados anormales podemos detectar con alta eficiencia cual es la enfermedad que el paciente tiene. Esto tiene enormes implicaciones, tanto para el diagnóstico exacto y la atención clínica del paciente, como para el desarrollo de nuevos tratamientos específicos para ambas enfermedades”. El estudio fue publicado el 5 de febrero de 2020 en la revista Nature.
Enlace relacionado:
Facultad de Medicina McGovern de la Universidad de Texas en Houston