Prueba en orina evalúa riesgo de desarrollar enfermedad renal aguda
Por el equipo editorial de LabMedica en español
Actualizado el 15 Oct 2014
Una prueba de laboratorio, primera en su clase, para ayudar a determinar si ciertos pacientes con enfermedades críticas están en riesgo de desarrollar insuficiencia renal aguda (IRA) moderada a severa, ha sido aprobada para su comercialización.Actualizado el 15 Oct 2014
Las pruebas de laboratorio actuales sólo pueden evaluar si un paciente ya tiene IRA; a menudo, el paciente ha progresado a IRA moderada a grave antes de que los resultados de la prueba confirman el diagnóstico clínico y los pacientes en estado crítico son aquellos que tienen el mayor riesgo de desarrollar insuficiencia renal aguda, en particular los pacientes que cumplen con ciertos factores como edad avanzada, diabetes y la presión arterial alta.
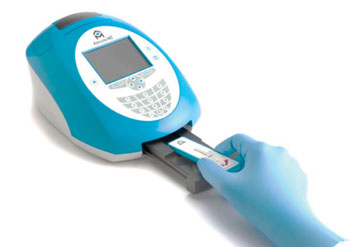
Imagen: El Sistema de Pruebas NephroCheck ayuda a evaluar el riesgo de daño renal agudo usando el Medidor Astute 40 (Fotografía cortesía de Astute Medical).
La revisión de la Dirección de Alimentos y Medicamentos de los EUA (FDA, Silver Springs, MD, EUA) incluyó dos estudios clínicos que evaluaron la seguridad y eficacia de la prueba. Los dos estudios compararon los diagnósticos clínicos de más de 500 individuos críticamente enfermos de 23 hospitales, a los resultados de la prueba. La prueba detectó con exactitud el 92% de los pacientes de IRA en un estudio y 76% en el otro. En ambos estudios, la prueba dio incorrectamente un resultado positivo en la mitad de los pacientes sin IRA. No hay otras pruebas actualmente en el mercado que hayan sido aprobadas por la FDA o aprobadas para evaluar el riesgo de desarrollar IRA en pacientes de riesgo.
La prueba, llamada Sistema NephroCheck Test (Astute Medical; San Diego, CA, EUA) detecta la presencia de la proteína de unión del factor de crecimiento similar a la insulina 7 (IGFBP7) y el inhibidor tisular de metaloproteinasas (TIMP-2) en la orina, que se asocian con la insuficiencia renal aguda. Al cabo de 20 minutos, el ensayo proporciona una puntuación basada en la cantidad de las proteínas presentes que se correlaciona con riesgo de desarrollar IRA dentro de las 12 horas siguientes a la realización de la prueba al paciente. El procedimiento de análisis implica que el operador aplique una muestra de orina fresca o descongelada mezclada con el conjugado fluorescente al cartucho de prueba NephroCheck, y luego insertar el cartucho de prueba en el medidor Astute140 para incubación, lectura, cálculo de resultados y obtención de los resultados.
Alberto Gutiérrez, PhD, director de la Oficina de Diagnósticos In Vitro y Salud Radiológica de la FDA, dijo: “La evaluación temprana y el tratamiento oportuno para la IRA pueden ayudar a prevenir el daño renal y las posibles complicaciones asociadas. El NephroCheck proporciona a los proveedores de atención de salud con un método rápido y validado para evaluar el estado de riesgo para IRA de un paciente que puede ayudar a tomar decisiones para el manejo de los pacientes. “La FDA revisó los datos para NephroCheck a través de la vía de revisión pre-comercialización de novo, una vía de reglamentación para algunos dispositivos médicos de riesgo bajo a moderado que no son sustancialmente equivalentes a un dispositivo ya comercializado legalmente.
Enlaces relacionados:
US Food and Drug Administration
Astute Medical