Técnica de biopsia ultra sensible monitoriza el riesgo de recurrencia del cáncer
Por el equipo editorial de LabMedica en español
Actualizado el 28 Aug 2019
Se puede utilizar una técnica de biopsia líquida ultrasensible, que se puede personalizar para cada paciente con cáncer de mama, para monitorizar al paciente a lo largo del tiempo y permitir la detección temprana de la recurrencia del tumor.Actualizado el 28 Aug 2019
El análisis del ADN tumoral que aparece en la circulación de un paciente puede proporcionar un medio no invasivo para detectar la presencia de un tumor y analizar su ADN en busca de mutaciones dirigibles. Sin embargo, es difícil detectar pequeñas cantidades de ADN tumoral en la sangre, especialmente en pacientes que ya recibieron un tratamiento de quimioterapia inicial.
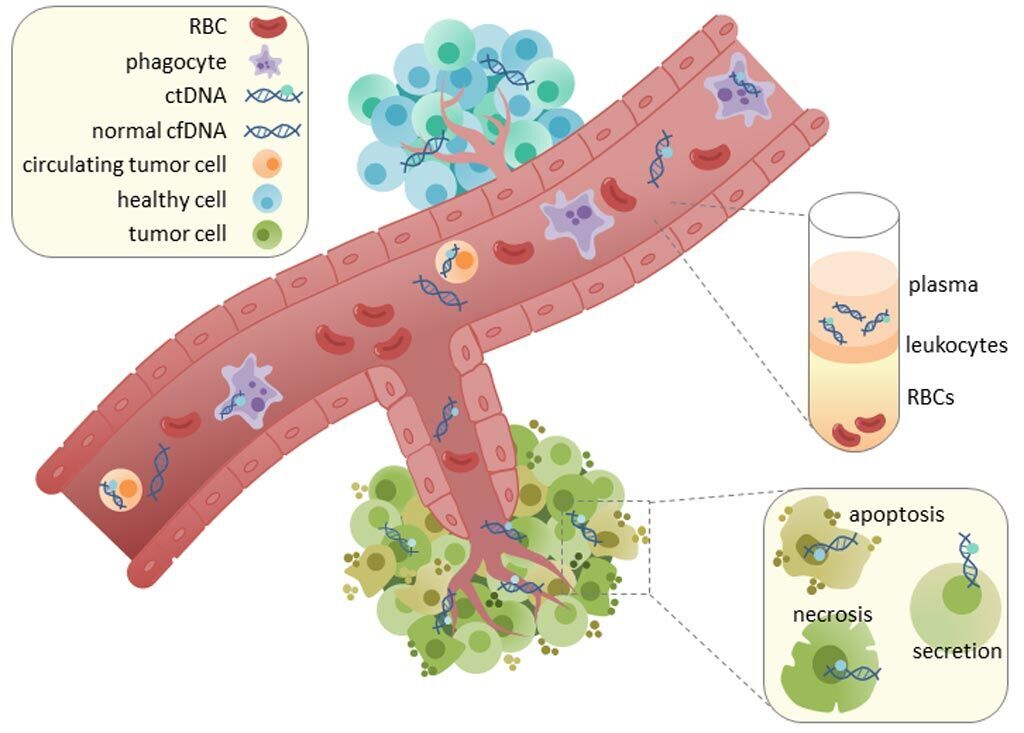
Imagen: El ADN tumoral circulante (ADNc) se encuentra en las fracciones de suero y plasma de la sangre. Se desconoce el mecanismo de liberación del ADNc, aunque se ha formulado la hipótesis de la apoptosis, la necrosis y la secreción activa de las células tumorales (Fotografía cortesía de Wikimedia Commons).
Para mejorar la sensibilidad del método de biopsia líquida para detectar pequeñas cantidades de ADN tumoral residual en plasma, los investigadores del Instituto de Investigación de Genómica Traslacional (Phoenix, AZ, EUA) y colaboradores en los Estados Unidos y el Reino Unido, desarrollaron un método llamado “secuenciación digital dirigida” (TARDIS) para el análisis multiplexado de mutaciones de cáncer específicas para cada paciente.
Según los investigadores, TARDIS combina las fortalezas de los métodos basados en PCR (minimizando las pérdidas de moléculas de ADN molde) y los métodos basados en la ligadura (incorporación de identificadores moleculares únicos (UMI), preservación de tamaños de fragmentos y multiplexación cien veces mayor). Esta combinación logra un equilibrio entre la profundidad y la amplitud del genoma tumoral analizado, investigando decenas a cientos de mutaciones específicas del paciente con una cobertura profunda. El método TARDIS se simplificó y automatizó para alcanzar con éxito el 55% de las mutaciones supuestas fundadoras por paciente en promedio. La técnica se basa en la síntesis rutinaria de cebadores con purificación estándar y requiere una huella de secuenciación limitada, lo que hace que este enfoque sea rentable y permita un análisis frecuente y longitudinal de muestras de plasma.
El ensayo TARDIS analiza una cantidad de ADN equivalente a un solo tubo de sangre y puede abordar simultáneamente de ocho a 16 mutaciones conocidas. En el estudio actual, TARDIS logró una mejora de hasta 100 veces más allá del límite actual de detección de ctADN utilizando volúmenes de sangre clínicamente relevantes, TARDIS detectó con éxito el ctADN en muestras de plasma de 33 pacientes con cáncer de mama antes de comenzar el tratamiento, y reveló que las pacientes habían tenido concentraciones más bajas de ADNc después de completar el tratamiento. Además, las pacientes que respondieron mejor a la quimioterapia mostraron una disminución del 96% en la abundancia de ADNc, mientras que los pacientes con enfermedad residual mostraron una disminución del 77%, lo que indica que la plataforma podría guiar el tratamiento personalizado de los pacientes con riesgo de recurrencia del cáncer.
“A través de la medición con precisión del ADNc, esta prueba puede detectar la presencia de cáncer residual e informar a los médicos si el tratamiento ha erradicado el cáncer con éxito”, dijo el autor principal, el Dr. Muhammed Murtaza, codirector de diagnósticos no invasivos del Instituto de Investigación Genómica Traslacional. “Los resultados de estas pruebas se podrían usar para individualizar la terapia contra el cáncer, evitando el sobretratamiento en algunos casos y el subtratamiento en otros. La premisa central de nuestra investigación es, si podemos desarrollar un análisis de sangre que pueda diferenciar a los pacientes que se han curado por completo, de los pacientes que tienen enfermedad residual. Nos preguntamos si podemos ver la eliminación del ADNc de la sangre en pacientes que responden bien al tratamiento prequirúrgico”.
El método TARDIS se describió en la edición en línea del 7 de agosto de 2019 de la revista Science Translational Medicine.
Enlace relacionado:
Instituto de Investigación de Genómica Traslacional