Se caracteriza la relación inmune con la evolución de tumores pulmonares
Por el equipo editorial de LabMedica en español
Actualizado el 10 Apr 2019
El carcinoma de pulmón de células no microcíticas (CPCNM) es cualquier tipo de cáncer de pulmón epitelial que no sea el carcinoma de pulmón de células pequeñas (CPCP). Los CPCNM representan aproximadamente el 85% de todos los cánceres de pulmón. Como clase, los CPCNM son relativamente insensibles a la quimioterapia, en comparación con los carcinomas de células pequeñas.Actualizado el 10 Apr 2019
La interacción entre un cáncer en evolución y un microambiente dinámico inmune sigue sin estar clara. Los científicos han comenzado a desentrañar las complejas relaciones entre la inmunoedición, la infiltración de células inmunes, la formación de neoantígenos y la evolución clonal en los tumores de cáncer de pulmón de células no pequeñas (CPCNM).
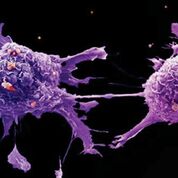
Imagen: Una microfotografía electrónica de barrido (SEM) de células de cáncer de pulmón (Fotografía cortesía de Cancer Research UK).
Un equipo de científicos del Instituto de Cáncer del Colegio Universitario de Londres (Londres, Reino Unido) usaron secuenciación de ARN, análisis de linfocitos infiltrantes de tumores, secuenciación de bisulfito de representación reducida y otros métodos para evaluar cientos de muestras de 88 casos de CPCNM, no tratados, en estadío temprano, seleccionados a partir de un conjunto de cánceres de pulmón previamente analizados por secuenciación del exoma multirregional para el proyecto Seguimiento de Evolución del Cáncer de Pulmón de Células no Microcítico a través de la Terapia (TRACERx).
Junto con los cambios en la metilación promotora para los genes con nuevas mutaciones productoras de antígenos, o neoantígenos, el equipo observó diferencias en la infiltración de células inmunes de un tumor a otro, y en diferentes partes del mismo tumor CPCNM. Esas diferencias de infiltración inmune parecían influir en la inmunoedición del tumor y en la medida en que los neoantígenos aparecieron en los tumores, destacando el impacto combinado que el microentorno del tumor, las mutaciones tumorales y la regulación génica alterada pueden tener sobre la evolución del tumor.
El grupo se centró en la infiltración de células inmunes en 258 regiones de 88 CPCNM en la cohorte TRACERx 100 secuenciadas con exoma, incluidas 164 regiones de 64 tumores que se evaluaron mediante ARN-seq. También consideraron los perfiles de linfocitos infiltrantes de tumores basados en histopatología para 234 regiones de 83 tumores de CPCNM. Después de observar qué tan bien se alinearon las estimaciones inmunes basadas en ARN-seq con los perfiles de linfocitos infiltrantes de tumores generados por la patología, el equipo comparó las características de expresión, mutación y metilación en el contexto de la región tumoral, los niveles de infiltración de células inmunes, los resultados de los pacientes y la histología de los tumores CPCNM involucrados.
Los resultados indicaron que más del 40% de los tumores tenían una infiltración inmune consistentemente baja, mientras que el 28% cada uno tenía una infiltración sistemáticamente alta o una infiltración inmune que variaba de acuerdo con la región. En los últimos tumores, observaron, la variabilidad en la infiltración inmune parecía coincidir con la heterogeneidad de la mutación tumoral. En los tumores de CPCNM con histología de adenocarcinoma, el equipo observó una disminución de la diversidad subclonal a medida que aumentaba la infiltración de células T CD8+ y viceversa, aunque este patrón no se mantuvo en los casos de carcinoma escamocelulares de pulmón.
Los investigadores encontraron pruebas que apoyan la idea de que los niveles de infiltración inmune influyeron sobre la inmunoedición tumoral, la evolución clonal y la pérdida de neoantígenos a través de cambios en el número de copias o disminución de la expresión del transcrito. Con el análisis de metilación basado en RRBS en 79 muestras de tumores de 28 casos, por ejemplo, detectaron un aumento significativo en la metilación del promotor en los genes con neoantígenos sin expresión.
Los autores concluyeron que sus resultados proporcionan evidencia de que la evolución del tumor se configura mediante mecanismos de inmunoedición que afectan a la presentación de antígenos o a través de mutaciones neoantigénicas en sí mismas, que suceden tanto a nivel de ADN como de ARN, argumentando que se debe considerar y aprovechar el papel beneficioso de la vigilancia inmunológica exitosa y la diversidad de evasión inmune en las intervenciones inmunoterapéuticas. El estudio fue publicado el 20 de marzo de 2019 en la revista Nature.
Enlace relacionado:
Instituto de Cáncer del Colegio Universitario de Londres