Se descubren las causas genéticas del carcinoma de las glándulas salivares
Por el equipo editorial de LabMedica en español
Actualizado el 19 Feb 2019
El carcinoma de células acínicas es la tercera forma maligna más común de cáncer de las glándulas salivares. Estos tumores son similares al tejido normal de las glándulas salivales y se presentan con mayor frecuencia en la glándula parótida. Hasta ahora, las causas moleculares de la enfermedad eran desconocidas.Actualizado el 19 Feb 2019
El carcinoma de células acínicas (AciCC) muestra una diferenciación serosa que se parece mucho a los acinos normales de las glándulas salivales, que producen los componentes principales de la saliva. Los reordenamientos regulatorios que conducen a la sobreexpresión del oncogén a través del secuestro del potenciador o la disfunción del aislante son cada vez más reconocidos en otros tipos de cáncer.

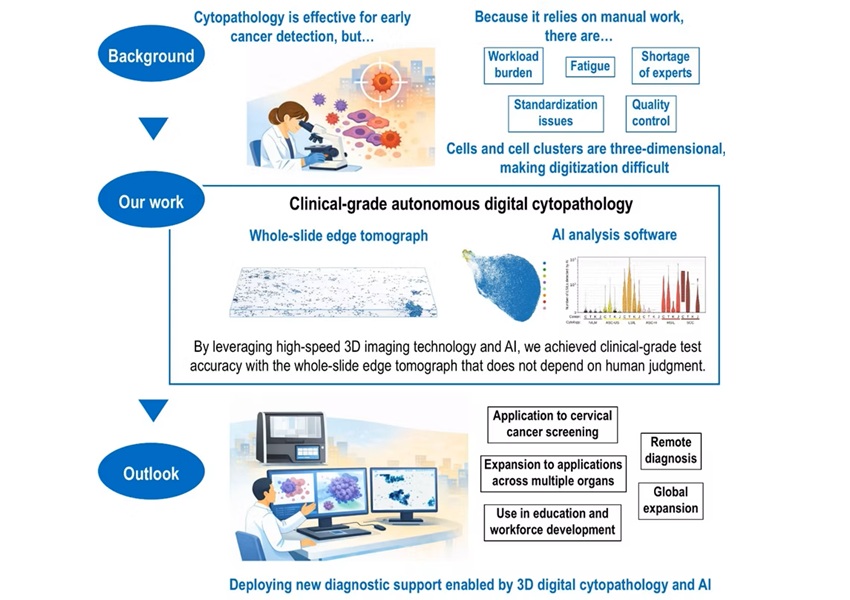
Imagen: El sistema Benchmark XT, un sistema de coloración totalmente automatizado (Fotografía cortesía de Ventana Medical Systems).
Un gran equipo de científicos dirigido por los de la Universidad de Erlangen-Nuremberg (Erlangen, Alemania) y sus colegas, inscribieron a 10 pacientes con diagnóstico de AciCC de las glándulas salivales en la cohorte del estudio inicial y su material tumoral se sometió a un extenso perfil genético y epigenético integral. Después de la fijación con formol y la inclusión en parafina del material tumoral, se realizó una micromatriz de tejido con dos núcleos de 2 mm por tumor utilizando el microarray automático de tejido TMA Grandmaster (3DHistech, Budapest, Hungría).
La inmunohistoquímica se realizó en cortes de 3 µm recién cortadas del bloque TMA utilizando un sistema de coloración totalmente automatizado, el sistema Benchmark XT (Ventana Medical Systems Inc, Tucson, AZ, EUA). Se obtuvieron imágenes representativas de áreas tumorales y de glándulas parótidas normales utilizando un microscopio Axio Imager A2 y AxioCam MRc con un aumento de × 400 (Carl Zeiss Microscopy GmbH, Jena, Alemania). La hibridación fluorescente in situ (FISH) se realizó en secciones recién cortadas de bloques de tejido tumoral. El ADN de los tumores AciCC y de las glándulas salivales normales se aisló de tejidos recién congelados utilizando kits de tejido DNeasy, y de la sangre de los mismos pacientes utilizando el kit de sangre DNeasy (todos de Qiagen, Hilden, Alemania). También se realizó secuenciación de bisulfito del genoma completo y secuenciación del ARN.
El equipo utilizó la secuenciación del genoma en el tejido tumoral e identificó una translocación de material genético entre los cromosomas 4 y 9, que estaba presente en todos los carcinomas de células acínicas examinados. Típicamente, tales translocaciones en tumores conducen a una nueva combinación de genes, que luego adquieren nuevas propiedades oncogénicas. En el caso de los carcinomas de células acinosas, la translocación que se ha descubierto hace que los elementos reguladores del ADN se transfieran de una región cromosómica activa a un oncogén normalmente inactivo.
Cuando los cromosomas se reorganizan, estos elementos reguladores altamente activos se ubican cerca del gen del Miembro 3 del Grupo A de la Subfamilia 4 del Receptor Nuclear (NR4A3), que generalmente se apaga una vez que se completa el desarrollo embrionario. Las señales de activación de los elementos reguladores en el carcinoma de células acínicas hacen que el gen se vuelva a activar. El NR4A3 actúa como un factor transcripcional para regular la actividad de una serie de otros genes, que luego desencadenan la división y el crecimiento celular, lo que finalmente lleva a que el tumor comience a crecer. El estudio fue publicado el 21 de enero de 2019 en la revista Nature Communications.
Enlace relacionado:
Universidad de Erlangen-Nuremberg
3DHistech
Ventana Medical Systems Inc
Carl Zeiss Microscopy GmbH
Qiagen