Se identifica la base genética de las cardiomiopatías de inicio infantil
Por el equipo editorial de LabMedica en español
Actualizado el 28 Nov 2018
La medicina personalizada es uno de los objetivos de los estudios médicos actuales, donde la comprensión de la causa genética y el mecanismo de la enfermedad en cada individuo promoverán formas de tratamiento a la medida. Los investigadores dieron un paso importante en esta dirección al descifrar las causas genéticas en los niños y sus implicaciones para las decisiones de tratamiento.Actualizado el 28 Nov 2018
La degeneración del músculo cardíaco (cardiomiopatía) es la causa más común de disfunción cardíaca grave y arritmias cardíacas potencialmente mortales en los niños. Estos trastornos graves a menudo conducen a considerar la posibilidad de un trasplante de corazón. Sin embargo, su causa real, la base genética, ha sido mal caracterizada.
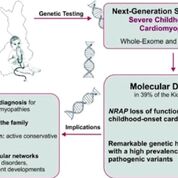
Imagen: Un diagrama de la cohorte KidCMP de niños con cardiomiopatías graves de los últimos 21 años que fueron analizados genéticamente (Fotografía cortesía de Catalina Vasilescu/Universidad de Helsinki).
Un esfuerzo de colaboración de cardiólogos pediátricos del Hospital Universitario de Helsinki (Helsinki, Finlandia) y de la Universidad de Helsinki (Helsinki, Finlandia) logró reunir una cohorte con KidCMP, única a nivel mundial, de 66 niños con cardiomiopatías severas de los últimos 21 años, y las analizaron genéticamente. La cohorte KidCMP presenta trastornos de aparición temprana y graves notables: la edad media de diagnóstico fue de 0,33 años y en 17 pacientes se practicó un trasplante cardíaco. Para el diagnóstico genético, se utilizaron la secuenciación de la próxima generación y la validación posterior utilizando métodos genéticos, de biología celular y computacionales.
El equipo identificó las variantes patógenas en el 39% de los pacientes: 46% de novo, 34% de herencia recesiva y 20% de herencia dominante. Informaron miocardiopatías dilatadas infantiles, subyacentes al gen NRAP así como fenotipos nuevos de genes conocidos de producir enfermedades del corazón. Algunos diagnósticos genéticos tienen implicaciones inmediatas para el tratamiento: CALM1 con arritmias que ponen en peligro la vida y TAZ con buen pronóstico cardíaco. Los genes de la enfermedad convergen en causas metabólicas (PRKAG2, MRPL44, AARS2, HADHB, DNAJC19, PPA2, TAZ, BAG3), vías MAPK (HRAS, PTPN11, RAF1, TAB2), vías de desarrollo (NEK8 y TBX20), vías de señalización de calcio (JPH2, CALM1, CACNA1C), y la vía del ciclo de contracción sarcomérica (TNNC1, TNNI3, ACTC1, MYH7, NRAP).
Los autores concluyeron que las cardiomiopatías infantiles suelen ser causadas por mutaciones raras específicas de la familia, más comúnmente de novo, lo que indica que la secuenciación de próxima generación de tríos es el método de elección en su diagnóstico. Los diagnósticos genéticos pueden sugerir estrategias de intervención y predecir el pronóstico, ofreciendo herramientas valiosas para la priorización de pacientes para trasplante versus tratamiento conservador.
Tiina Ojala, MD, PhD, cardióloga pediátrica y autora principal del estudio, dijo: “Todos los niños tenían enfermedades potencialmente mortales desde el principio y algunos defectos genéticos predecían un trastorno principalmente progresivo que requería trasplante cardíaco. Sin embargo, si se tratan de forma intensiva, algunos defectos genéticos predecían un curso de recuperación, sin necesidad de trasplante”. El estudio fue publicado en la edición de noviembre de 2018 de la revista Journal of the American College of Cardiology.
Enlace relacionado:
Hospital Universitario de Helsinki
Universidad de Helsinki