Prueba de biopsia líquida para cáncer de pulmón
Por el equipo editorial de LabMedica en español
Actualizado el 11 Jan 2017
Aproximadamente el 20% de los pacientes con cáncer de pulmón de células no pequeñas (NSCLC) son positivos para una mutación promotora del receptor del factor de crecimiento epidérmico (EGFR) y reciben terapia con inhibidores EGFR de tirosina quinasa (TKI), pero la mayoría desarrollará resistencia a este tipo de terapia.Actualizado el 11 Jan 2017
Las biopsias de tejido son el estándar actual para identificar la resistencia a T790M. La mutación T790M da como resultado una sustitución de aminoácidos en la posición 790 en EGFR, en que se cambia una treonina (T) por una metionina (M). Esta mutación se produce dentro del exón 20, que codifica parte del dominio quinasa. Si un paciente tiene esta mutación, es elegible para el tratamiento con una terapia de segunda línea de EGFR TKI. Desafortunadamente, una biopsia de tejido no siempre es una opción viable para un gran porcentaje de estos pacientes.
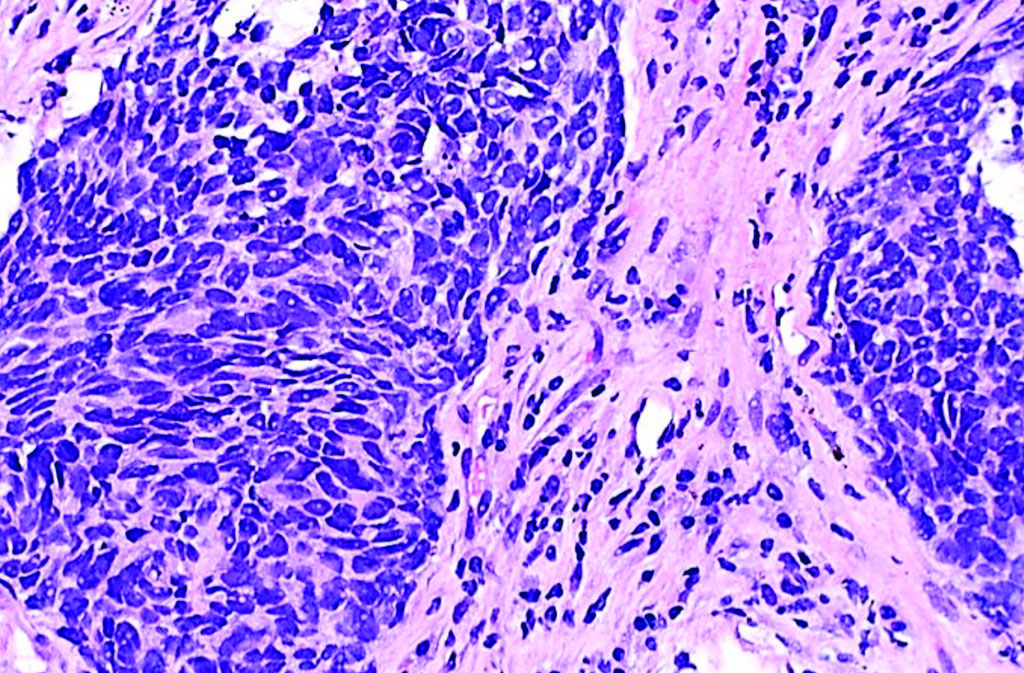
Imagen: Una histopatología de un carcinoma pulmonar de células no pequeñas (Fotografía cortesía de Librepath).
Las biopsias líquidas, no invasivas, han surgido como una alternativa viable para los pacientes que no pueden someterse a un procedimiento de biopsia de tejido. Exosome Diagnostics Inc. (Cambridge, MA, EUA) ha presentado datos que establecen un nuevo estándar para la detección de mutaciones de resistencia a EGFR-T790M, en el cáncer de pulmón, con la mayor sensibilidad reportada hasta la fecha. Esta prueba se está desarrollando para mejorar la atención y los resultados para la gran población de pacientes que pueden beneficiarse de la terapia de segunda línea, con EGFR TKI, pero que se pasan por alto con las pruebas de biopsia en tejidos y líquidas, disponibles.
Los estudios clínicos han demostrado que la prueba cobas, aprobada por la Agencia de Medicamentos y Alimentos de los EUA (Silver Springs, MD, EUA), para la biopsia líquida, sólo identifica el 59% de los pacientes que responderán a una terapia de segunda línea con EGFR TKI. Esto es un resultado directo de la falta de sensibilidad e incapacidad para analizar la enfermedad intratorácica desafiante. Mediante el análisis del ácido ribonucleico exosomal (exoARN) y el ADN celular libre de células (ctADN) de la misma muestra, Exosome Dx aborda las limitaciones actuales al identificar el 96% de la población positiva para T790M, sin pérdida de sensibilidad en los pacientes con enfermedad intratorácica. ExoDx Lung (T790M) ha sido diseñado, de forma óptima, para la plataforma de análisis de biomarcadores de alto rendimiento de ExosomeDx que será implementada en 2017.
Johan Skog, PhD, director científico de Exosome Diagnostics, dijo: “Este estudio demuestra, aún más, el poder de nuestra plataforma ExoLution Plus que combina el exoARN con el ctADN. Este resultado no fue sorprendente, ya que hemos demostrado un rendimiento superior al ctADN a través de varios estados de enfermedad en estudios ciegos, cabeza a cabeza. Las muestras clínicas son preciosas, por lo que estamos encantados de poder ofrecer una prueba más sensible que tenga en consideración tanto el exoARN como el ctADN”. El estudio fue presentado en el congreso AACR-EORTC-NCI, celebrado del 29 de noviembre al 2 de diciembre de 2016, en Múnich, Alemania.
Enlaces relacionados:
Exosome Diagnostics Inc
US Food and Drug Administration