Los CDC suministran protocolo de análisis para el nuevo coronavirus
Por el equipo editorial de LabMedica en español
Actualizado el 12 Feb 2020
Los Centros para el Control y la Prevención de Enfermedades de los EUA (Atlanta GA, EUA) publicaron su ensayo para el nuevo coronavirus 2019-nCoV y ahora desarrollan los kits para análisis. La prueba de diagnóstico de los CDC es un ensayo de PCR en tiempo real de transcriptasa inversa (rRT-PCR) desarrollado para muestras respiratorias y de suero sanguíneo. El protocolo para hacer el ensayo se puso a disposición del público.Actualizado el 12 Feb 2020
Específicamente, si una persona se identifica con un historial de viaje o contacto que podría haber provocado exposición, y también tiene fiebre y enfermedad respiratoria, generalmente se alerta a un departamento de salud. A través de la discusión con los CDC, se determina si los diagnósticos son meritorios y se envía una muestra a los CDC. En total, se han investigado o están en investigación 260 personas en 26 estados por infección por el 2019-nCoV. Hasta la fecha, la agencia ha evaluado a 2.400 personas en cinco puertos de entrada de los Estados Unidos seleccionados. Los CDC continúan evaluando la situación de salud pública a medida que evoluciona, dijo, y agregó que los CDC probablemente proporcionarán orientación sobre posibles restricciones de viaje adicionales en los próximos días.
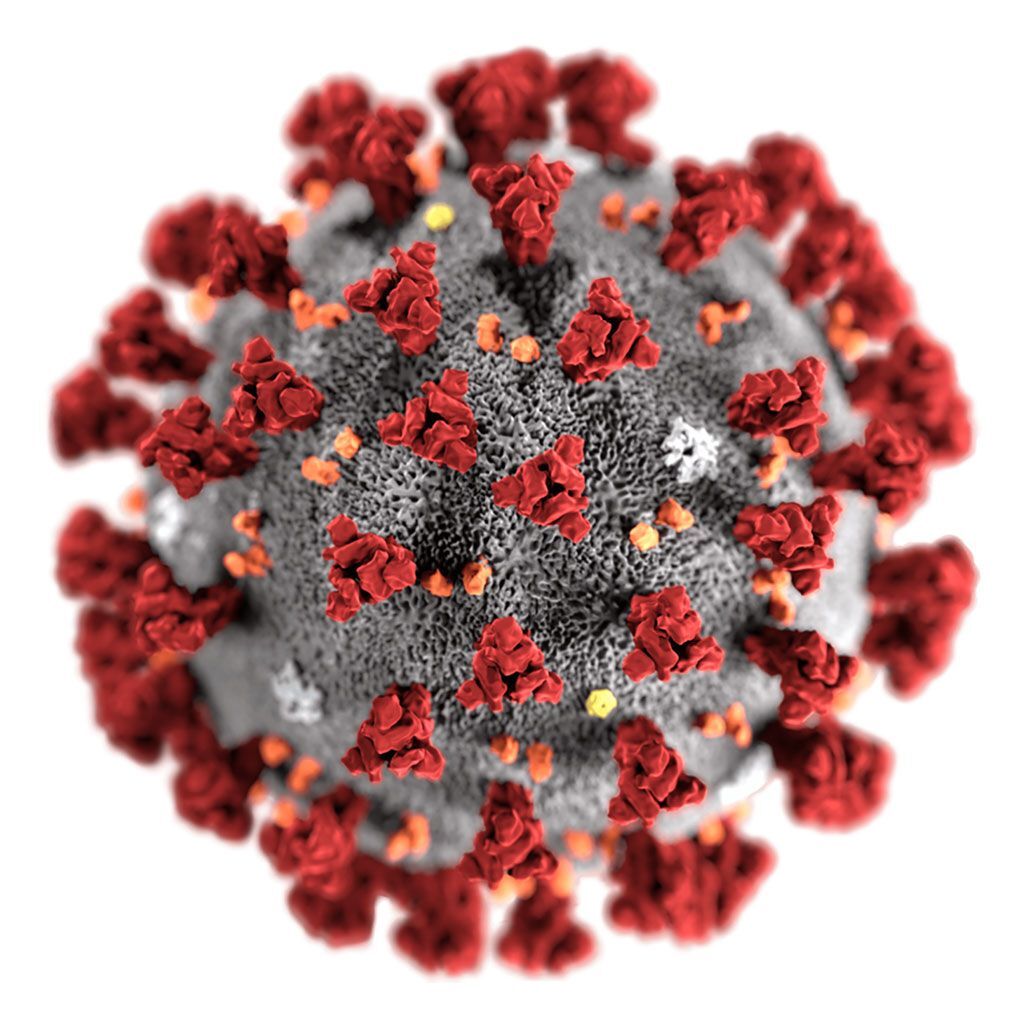
Imagen: Ilustración de un virión del nuevo coronavirus de 2019 (nCoV) (Fotografía cortesía de Alissa Eckert, MS / CDC).
El protocolo especifica cebadores y sondas, proporciona orientación sobre la preparación de las muestras y aconseja realizar rRT-PCR en el termociclador AB 7500 Fast DX (Thermo Fisher Scientific, Waltham, MA, EUA). La guía provisional de la agencia para las pruebas para el 2019-nCoV indica precauciones de bioseguridad al momento de usar RNase Away o una solución recién preparada de blanqueador al 10% para la limpieza. Además de los 11 casos confirmados como positivos en los EUA, con la prueba rRT-PCR, y 167 casos confirmados como negativos, también hay 82 casos pendientes, que según dijo la agencia en su sitio web, incluyen muestras recibidas y que se encuentran en espera de pruebas, así como muestras en ruta a los CDC.
Nancy Messonnier, MD, directora del Centro Nacional de Inmunización y Enfermedades Respiratorias, dijo: “El lapso de tiempo entre la decisión de que un paciente necesita más pruebas de laboratorio y el resultado de una prueba es de alrededor de un día, dependiendo de la ubicación geográfica del sitio donde se atiende a ese paciente y la forma cómo podemos enviar más eficientemente las muestras. Esto es esencialmente un plano para hacer la prueba. Actualmente refinamos el uso de esta prueba para poder brindar una orientación óptima a los estados y laboratorios sobre cómo usarla”.
Enlace relacionado:
Centros para el Control y la Prevención de Enfermedades de los EUA
Thermo Fisher Scientific