Examinan el uso de la infiltración linfocítica como biomarcador para los tumores colorrectales estables
Por el equipo editorial de LabMedica en español
Actualizado el 13 Oct 2020
La identificación de los pacientes en estadio II con cáncer colorrectal (CCR) con mayor riesgo de progresión es una prioridad clínica para optimizar las ventajas de la quimioterapia adyuvante y evitar una toxicidad innecesaria. Una característica notable del CCR es la diferencia en el pronóstico de los pacientes diagnosticados en las etapas tempranas y tardías de la enfermedad.Actualizado el 13 Oct 2020
Las células inmunes claramente juegan un papel importante en la tumorigénesis, porque la evasión de la vigilancia inmunológica y/o la supresión del sistema inmunológico se han descrito como un sello distintivo de las células cancerosas. Además, es bien sabido que las interacciones tumores-sistema inmune ofrecen información de pronóstico importante para algunos pacientes con cáncer.
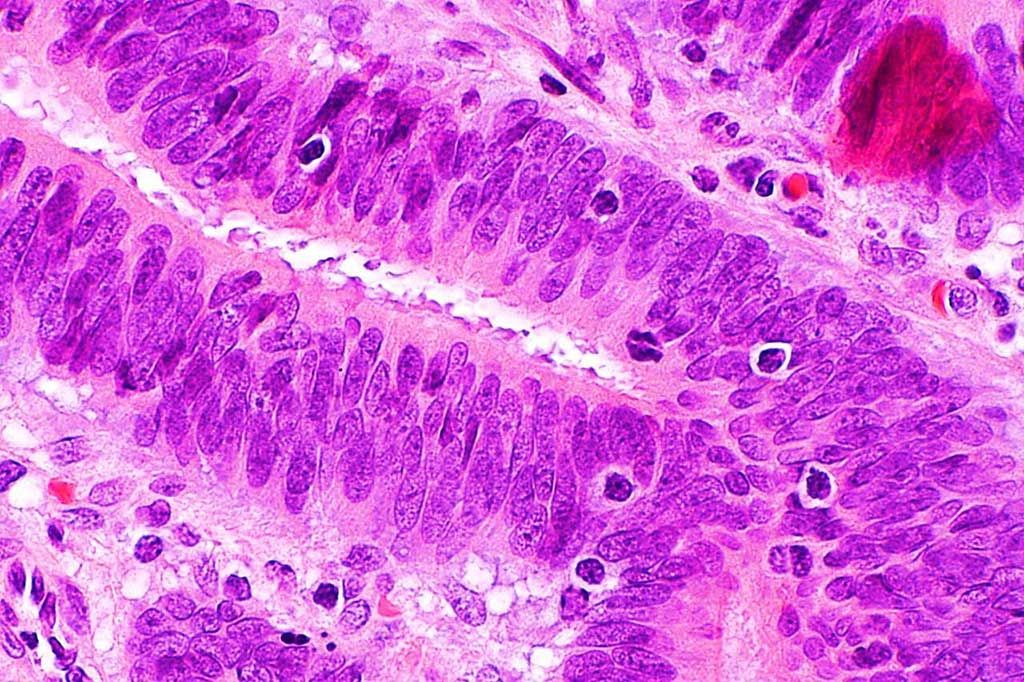
Imagen: Microfotografía que muestra linfocitos infiltrantes de tumores en el carcinoma colorrectal que sugieren inestabilidad de los microsatélites (Fotografía cortesía de Nephron).
Un equipo internacional de científicos que colabora con la Universidad de Barcelona (Barcelona, España), evaluó la utilidad de las medidas de infiltración de células T como biomarcadores de pronóstico en 640 tumores de CCR en estadio II, 582 de ellos confirmaron microsatélites estables. El equipo midió tanto la cantidad como el índice de clonalidad de las células T por medio de la inmunosecuenciación del receptor de células T (TCR) en un conjunto de datos de descubrimiento (95 pacientes con cáncer de colon diagnosticado en estadio II y microsatélites estables, mediana de edad 67 años, 30% mujeres) y replicó los resultados en tres series adicionales de pacientes en estadio II, de dos países.
Todas las muestras de los conjuntos de datos se analizaron mediante inmunosecuenciación. Se utilizó un sistema de reacción en cadena de la polimerasa múltiple (PCR), para amplificar las secuencias de CDR3β variables del TCR a partir de segmentos de ADN en siete familias de genes, 10 segmentos huérfanos en 10 familias de genes, ambos genes D y 13 segmentos J funcionales. Este método generó un fragmento de 87 pares de bases capaz de identificar la región VDJ que abarca cada CDR3β única. Luego, los amplicones se secuenciaron usando la plataforma HiSeq (Illumina, San Diego, CA, EUA).
Además de la inmunosecuenciación, la infiltración linfocítica de la serie se analizó mediante portaobjetos histológicos coloreados con hematoxilina y eosina (HE), utilizados para el diagnóstico. Las muestras de tumores de la serie de descubrimientos fueron examinadas por dos patólogos y calificadas para determinar la abundancia de estroma y linfocitos. Se estudiaron tres variables histológicas: linfocitos estromales (STL), linfocitos infiltrantes de tumor (TIL) y la proporción de estroma/tumor. Para analizar los STL, el patólogo evaluó cinco regiones histológicas en un campo de gran aumento (× 400) midiendo el porcentaje de linfocitos y células plasmáticas (excluidos los neutrófilos polimorfonucleares) en relación con el estroma circundante del tumor.
Los científicos informaron que se descubrió un valor pronóstico de la abundancia y clonalidad de los TCR en un estudio retrospectivo de 95 pacientes de colon en estadio II. Estos resultados se replicaron en dos estudios retrospectivos adicionales de España (N = 112 y 163) y otro de Israel (N = 270). Los resultados se confirmaron tanto cuando se analizaron tejidos frescos congelados, como incluidos en parafina mediante secuenciación inmune. La alta abundancia de TCR y el bajo índice de clonalidad (repertorio más diverso) se asociaron con un mejor pronóstico. Aunque están parcialmente correlacionados, ambos proporcionan información de pronóstico complementaria.
Los autores concluyeron que la evaluación de linfocitos tumorales mediante la técnica de inmunosecuenciación de TCR, que combina información sobre abundancia y clonalidad, es un biomarcador pronóstico independiente en tumores estables con microsatélites, en estadio II. El estudio fue publicado el 24 de septiembre de 2020 en la revista PLOS Medicine.
Enlace relacionado:
Universidad de Barcelona