Lanzamiento de prueba múltiplex de VIH-sífilis
Por el equipo editorial de LabMedica en español
Actualizado el 10 Dec 2013
Existen pruebas únicas de sangre total por el método de pinchazo en el dedo, que permiten reducir la transmisión de la madre al bebé, del virus de inmunodeficiencia humano (VIH) y del Treponema pallidum, agente causante de la sífilis.Actualizado el 10 Dec 2013
A nivel global, es mayor la cantidad de mujeres infectadas con sífilis que con VIH y los análisis prenatales con pruebas diagnósticas en el punto de atención (POCT) constituyen una herramienta esencial para prevenir la transmisión de ambas enfermedades al feto.
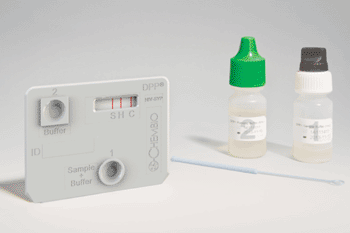
Imagen: Prueba dual de VIH 1 y 2, y prueba treponémica de detección de anticuerpos de la sífilis para el punto de atención (Fotografía cortesía de Chembio Diagnostics).
La prueba de VIH-sífilis de tecnología Dual Path Platform (DPP(R)) de (Chembio Diagnostics; Medford, NY, EUA) constituye una plataforma POCT con buena capacidad de multiplexación. Se ha agregado un biomarcador de sífilis a la prueba de DPP(R) de VIH 1 y 2 de la empresa, ya aprobada por la Administración de Alimentos y Medicamentos (FDA, Silver Springs, MD, EUA). La prueba DPP de Chembio de detección del VIH-sífilis es una prueba inmunocromatográfica, rápida y de uso individual para la detección de anticuerpos de los tipos 1 y 2 del virus de inmunodeficiencia humana (HIV 1 y 2) y el T. pallidum de la sífilis en sangre total, sangre venosa total, suero y plasma, por el método de pinchazo en el dedo.
El análisis DPP(R) de VIH-sífilis también fue aprobado para su inclusión en la lista de exención de la Agencia de los Estados Unidos para el Desarrollo Internacional (USAID; Washington DC, EUA), que a juicio de la empresa es el primer producto de VIH-sífilis aprobado en base a la lista de exenciones de más reciente publicación de la USAID. La aprobación de la USAID implica que le prueba se somete a estudios de laboratorio de la Rama de Laboratorio Internacional de los Centros para el Control de las Enfermedades (CDC; Atlanta, GA, EUA) para verificar el desempeño del producto en varios lotes de producción para asegurar un desempeño consistente. La empresa considera que los resultados de la evaluación del CDC se publicarán oportunamente. Chembio también está gestionando la marca CE de conformidad europea y la aprobación de la FDA para este producto.
La empresa recibió una orden de compra de México tras la evaluación favorable de sensibilidad y especificidad de esta prueba realizada en el Instituto de Diagnóstico y Referencia Epidemiológicos (InDRE; Escandon, México). El análisis de la prueba de VIH-sífilis DPP(R) de Chembio realizada por el InDRE dio como resultado una sensibilidad de 100% y una especificidad de 100% en todas las muestras analizadas.
Javan Esfandiari, MSc, vicepresidente principal de investigación y desarrollo de Chembio dijo: “Creemos que los resultados de los análisis del InDRE junto con la inclusión en la lista de exenciones de la USAID significan una validación convincente del producto DPP(R) de Chembio, HIV-Syphilis, destinada a programas sanitarios de todo el mundo. También estamos ansiosos por desarrollar muchas oportunidades para este producto en todo el mundo donde existe una gran necesidad de detectar tanto el VIH como la sífilis en los programas de pruebas prenatales y la aprobación de USAID facilitará estas oportunidades.”
Enlaces relacionados:
Chembio Diagnostics
United States Food and Drug Administration’s
United States Agency for International Development
United States Centers for Disease Control
Institute of Epidemiological Diagnosis and Reference