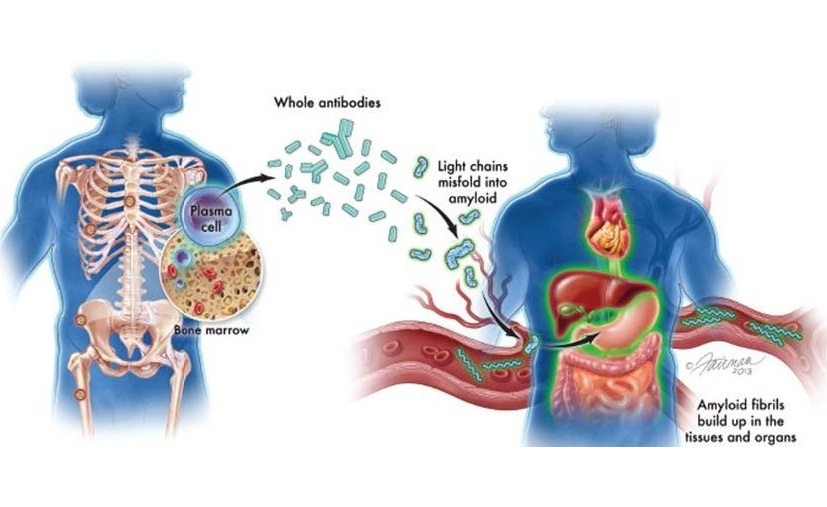
Arquitectura de células madre promueve progresión del síndrome mielodisplásico
Actualizado el 16 Mar 2022
Los síndromes mielodisplásicos son un grupo de enfermedades en las que la médula ósea no produce suficientes células sanguíneas sanas. Las enfermedades se originan a partir de células conocidas como células madre hematopoyéticas (HSC) que pueden perseverar e incluso crecer durante el tratamiento estándar con agentes hipometilantes (HMA).
Los avances en las tecnologías de secuenciación han brindado información sobre los mecanismos genéticos que contribuyen a la progresión del SMD a leucemia mieloide aguda secundaria (sLMA). Las células SMD aberrantes que residen en el compartimento HSC definido inmunofenotípicamente son la fuente de la progresión de la enfermedad, pero aún se desconoce en gran medida cómo estas células contribuyen al fracaso de la terapia y la evolución de la enfermedad.

Un gran equipo de hematólogos especializados en leucemias del Centro Oncológico MD Anderson de la Universidad de Texas (Houston, TX, EUA), analizó más de 400 muestras de pacientes con SMD tomadas en diferentes etapas de la enfermedad. Utilizaron el perfil molecular integrador de las HSC y descubrieron que las HMA eliminaban las células cancerosas maduras, pero dejaban vivas a las células madre, lo que provocaba una recaída de la enfermedad.
Se realizaron análisis de citometría de flujo cuantitativos y FACS de células mononucleares vivas humanas (MNC) y células CD34+, utilizando protocolos de coloración estándar para paneles de antígenos y anticuerpos establecidos. Las muestras utilizadas para la citometría de flujo y FACS se adquirieron con un clasificador de células BD LSR Fortessa o BD Influx (BD Biosciences, San José, CA, EUA). Durante el tratamiento, se recolectaron periódicamente muestras de sangre periférica (SP) en tubos recubiertos con EDTA y se realizaron hemogramas completos con un analizador de hematología ABX Pentra automatizado (Horiba, Northampton, Reino Unido). También se extrajo y procesó el ADN total de células mononucleares de la medula ósea (MNC), de los neutrófilos y de las células T.
La comparación de muestras de médula ósea de pacientes no tratados con las de donantes sanos reveló que las muestras de SMD se podían dividir en dos grupos según el perfil de esas células madre. Las muestras de uno de los grupos de SMD tenían un patrón anormal de aumento de la frecuencia de progenitores mieloides comunes (CMP) dentro del compartimento de células progenitoras hematopoyéticas mieloides. El otro grupo de SMD tenía una mayor frecuencia de progenitores granulocíticos-monocíticos (GMP) dentro del compartimento. En ambos grupos, las poblaciones de células madre mantuvieron la enfermedad durante el tratamiento y se expandieron después del fracaso de la terapia con HMA, lo que impulsó la progresión de la enfermedad.
Las expansiones de cada uno de estos tipos de células madre de los SMD dependieron de la activación de vías de señalización específicas exclusivas de cada grupo: la vía de supervivencia BCL2 en el grupo CMP y la señalización NF-κB en el grupo GMP. Los pacientes con SMD con patrón CMP tuvieron un tiempo más corto para lograr la remisión completa en comparación con aquellos con el patrón GMP (1,2 meses frente a 6,5 meses) y una duración de supervivencia libre de recaídas más larga (16,3 meses frente a 5,2 meses). Juntos, estos hallazgos sugieren que los pacientes con SMD con patrón CMP con progresión blástica pueden beneficiarse del tratamiento con el inhibidor altamente selectivo de BCL2, venetoclax.
Simona Colla, PhD, profesora asociada de leucemia y autora principal del estudio, dijo: “La mayoría de los casos de SMD no responden a las terapias actuales o recaen. Este estudio proporciona una nueva perspectiva sobre las causas del fracaso de la terapia y la progresión de la enfermedad en los SMD y posiblemente proporcione opciones de tratamiento específicas para estos pacientes”.
Los autores concluyeron que los datos sugieren que se debe considerar la arquitectura celular de los SMD como un biomarcador para predecir las vulnerabilidades intrínsecas de las células que se expanden en la recaída y, por lo tanto, para guiar el diseño o la elección de enfoques terapéuticos específicos dirigidos a estas células, particularmente en el contexto de la terapia basada en venetoclax. El estudio fue publicado el 3 de marzo de 2022 en la revista Nature Medicine
Enlaces relacionados:
Centro de Cáncer MD Anderson de la Universidad de Texas
BD Biosciences
Horiba









 Analyzer.jpg)