Se autoriza una prueba de próxima generación para la enfermedad residual mínima
Por el equipo editorial de LabMedica en español
Actualizado el 24 Oct 2018
Se calcula que 6.000 personas en los EUA serán diagnosticadas con leucemia linfoide aguda (LLA) y que 31.000 personas serán diagnosticadas con mieloma múltiple este año.Actualizado el 24 Oct 2018
En los pacientes con estas enfermedades, la enfermedad residual mínima (ERM) es una medida para determinar cuántas células cancerosas permanecen en su médula ósea después del tratamiento, lo que puede ser indicativo de su respuesta al tratamiento y del alcance de su remisión. Actualmente, la ERM se mide utilizando ensayos de citometría de flujo o ensayos basados en la reacción en cadena de la polimerasa (PCR), que pueden captar 1 célula entre 10.000 células o 1 célula entre 100.000 células.
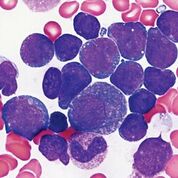
Imagen: Aspirado de médula ósea de un paciente con leucemia linfoide aguda que revela un aumento en el número de blastos de tamaño pequeño a mediano, con relaciones altas núcleo a citoplasma, núcleos redondos a irregulares, cromatina lisa y una cantidad escasa de citoplasma agranular basófilo. En el fondo, se observan algunas células mieloides en maduración que también están presentes en este caso (Fotografía cortesía de la Dra. Karen M. Chisholm).
La autorización de clonoSEQ (Adaptive Biotechnologies, Seattle, WA, EUA) por parte de la Administración de Medicamentos y Alimentos de los Estados Unidos (FDA, Silver Springs, MD, EUA) se basó en el análisis retrospectivo de tres estudios en que, en conjunto, participaron muestras de 273 pacientes con LLA y más de 1.000 pacientes con mieloma múltiple. Los pacientes con LLA con ERM negativa tuvieron una supervivencia más larga sin eventos (el tiempo después del tratamiento que un paciente está libre de complicaciones u otros eventos), mientras que aquellos con resultados más altos de ERM tuvieron tasas de supervivencia más bajas sin eventos.
ClonoSEQ se utilizó para demostrar que la ERM se asoció de manera similar con la supervivencia sin progresión, la cantidad de tiempo durante y después del tratamiento que la enfermedad de un paciente no empeora y la supervivencia sin enfermedad, la cantidad de tiempo después del tratamiento primario contra el cáncer en que un paciente no tiene ningún signo de ese cáncer. El ensayo clonoSEQ aprovecha el poder de la inmunosecuenciación junto con los avances innovadores en química y bioinformática patentada para evaluar la presencia de células malignas en niveles por debajo del límite de detección de los métodos citomorfológicos convencionales. Cuando se proporciona una muestra suficiente, el ensayo puede identificar de forma rutinaria la presencia de una célula cancerosa en una muestra de un millón de células sanas.
Enlace relacionado:
US Food and Drug Administration
Adaptive Biotechnologies