Prueba genética podría predecir malos resultados en pacientes con trasplante de pulmón
Actualizado el 02 Jul 2025
El trasplante de órganos ha transformado drásticamente el tratamiento de los pacientes con insuficiencia orgánica. Sin embargo, el sistema inmunitario del receptor suele percibir el órgano trasplantado como un ente extraño, lo que desencadena una reacción defensiva que puede provocar complicaciones graves. El síndrome de bronquiolitis obliterante (SBO) es una de estas complicaciones, común tras el trasplante de pulmón (TP) y el trasplante de células madre hematopoyéticas (TCMH). El SBO se caracteriza por estrechamiento de las vías respiratorias, fibrosis e inflamación pulmonar, lo que provoca problemas respiratorios y una baja supervivencia del injerto. Si bien se han investigado exhaustivamente las respuestas inmunitarias y los rasgos patológicos y morfológicos coincidentes del SBO tras el TP y el TCMH, aún se desconocen las razones por las que solo algunos pacientes desarrollan SBO y los factores genéticos que podrían influir en las respuestas individuales a las enfermedades y tratamientos. Un nuevo estudio demuestra que las pruebas genéticas pueden ayudar a identificar a los pacientes con mayor riesgo de desarrollar complicaciones tras el trasplante, lo que permite tomar medidas preventivas de forma más temprana.
Un equipo de investigación de la Universidad Nacional de Pusan (Busan, Corea del Sur) examinó las variaciones genéticas en los tejidos pulmonares obtenidos de pacientes que desarrollaron SBO después de someterse a un TP o un TCMH. Utilizaron la secuenciación del genoma completo (WGS) en el ADN extraído de tejido pulmonar y muestras de sangre de estos pacientes, luego evaluaron los datos para variantes genéticas como polimorfismos de un solo nucleótido (SNP), inserciones y deleciones, y sustituciones de bases. Se encontró que los SNP eran la variante más prevalente en ambos grupos, con 731 identificados en pacientes con SBO post-TP y 990 en aquellos con SBO post-TCMH. La carga mutacional también fue mayor en el grupo de SBO post-TCMH en comparación con el grupo de SBO post-TP. Se encontraron mutaciones en los genes FCGBP y POM121 en ambos grupos de pacientes y estaban presentes tanto en el tejido pulmonar como en las muestras de sangre.
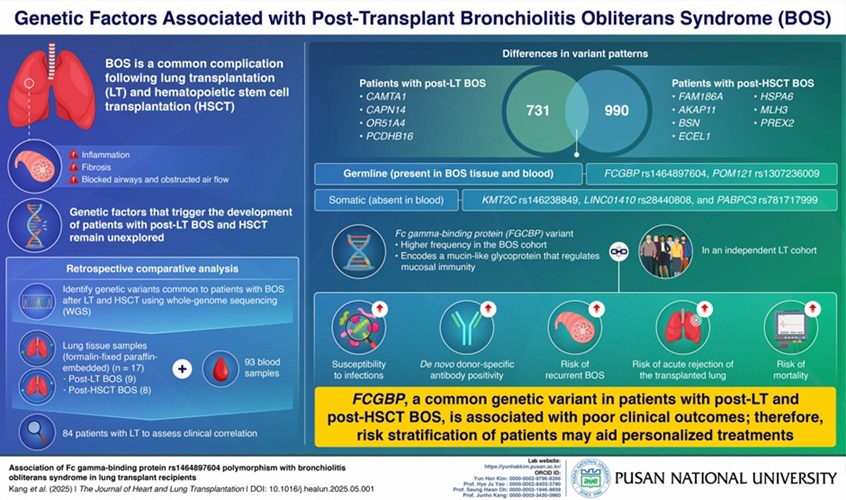
La variante del gen FCGBP fue elegida para un análisis más profundo debido a su alta prevalencia entre los pacientes con SBO y su presunta participación en el control de la inmunidad de la mucosa dentro de los pulmones. Significativamente, las personas portadoras de la variante FCGBP tuvieron una mayor probabilidad de experimentar SBO recurrente, infecciones y eventos de rechazo agudo, que se asociaron con mayores niveles de anticuerpos específicos del donante, factores que juntos aumentan la carga general de enfermedad y el riesgo de mortalidad. Según los hallazgos publicados en The Journal of Heart and Lung Transplantation, la detección de la variante FCGBP podría permitir a los médicos identificar a las personas de alto riesgo e iniciar tratamientos inmunosupresores personalizados en el momento adecuado. Además, obtener una comprensión más clara de cómo funciona la FCGBP en la regulación inmunológica podría respaldar el desarrollo de nuevas terapias dirigidas a proteger el tejido pulmonar y mejorar los resultados a largo plazo para los receptores de trasplantes.
“Al analizar esta variación genética antes o poco después del trasplante, los médicos pueden ajustar el plan de tratamiento, monitorear a los pacientes más de cerca y tomar medidas preventivas para reducir el riesgo de complicaciones como el síndrome de Sjögren (SSB)”, afirmó el profesor adjunto Yun Hak Kim, quien dirigió la investigación. “En el futuro, esta variante genética también podría detectarse en análisis de sangre rutinarios para monitorear la salud del paciente tras el trasplante y orientar la atención a largo plazo de forma más eficaz”.
Enlaces relacionados:
Universidad Nacional de Pusan