Técnica de detección identifica genes responsables del daño a células cardíacas por quimioterapia
Actualizado el 05 Dec 2024
La doxorrubicina es un potente fármaco de quimioterapia que ataca eficazmente a las células cancerosas, pero también altera las células cardíacas, provocando que latan de forma irregular, se organicen de forma incorrecta o incluso mueran. Cuando se utiliza en dosis altas o durante períodos prolongados, la doxorrubicina puede provocar insuficiencia cardíaca, lo que limita su uso a pesar de su eficacia contra el cáncer. Ahora, los investigadores pueden haber descubierto por qué la doxorrubicina daña las células cardíacas y han identificado un fármaco que podría mantenerlas latiendo.
Un equipo de investigadores de Stanford Medicine (Stanford, CA, EUA) ha desarrollado una herramienta de cribado genético que utiliza CRISPR, una potente tecnología de edición genética, para identificar genes implicados en el daño cardíaco inducido por doxorrubicina. A través de este método, identificaron un gen que parecía desempeñar un papel clave en los efectos nocivos del fármaco sobre el corazón. Aunque se sabía que la doxorrubicina daña las células cardíacas, no estaban claros los genes específicos responsables de este daño. Los investigadores centraron su búsqueda en 2.300 genes que ya son objetivo de los fármacos existentes. Utilizaron una novedosa técnica de cribado genético para observar los efectos de la doxorrubicina en las células cardíacas derivadas de células madre pluripotentes inducidas, que pueden diferenciarse en cualquier tipo de célula. Al utilizar CRISPR para activar o desactivar genes individuales dentro de estas células cardíacas, los investigadores expusieron las células a la doxorrubicina y observaron cuáles sobrevivieron. El siguiente paso fue entender por qué sobrevivieron estas células. Para descubrirlo, los investigadores secuenciaron el ADN de cada célula, buscando marcadores genéticos asociados con la supervivencia.
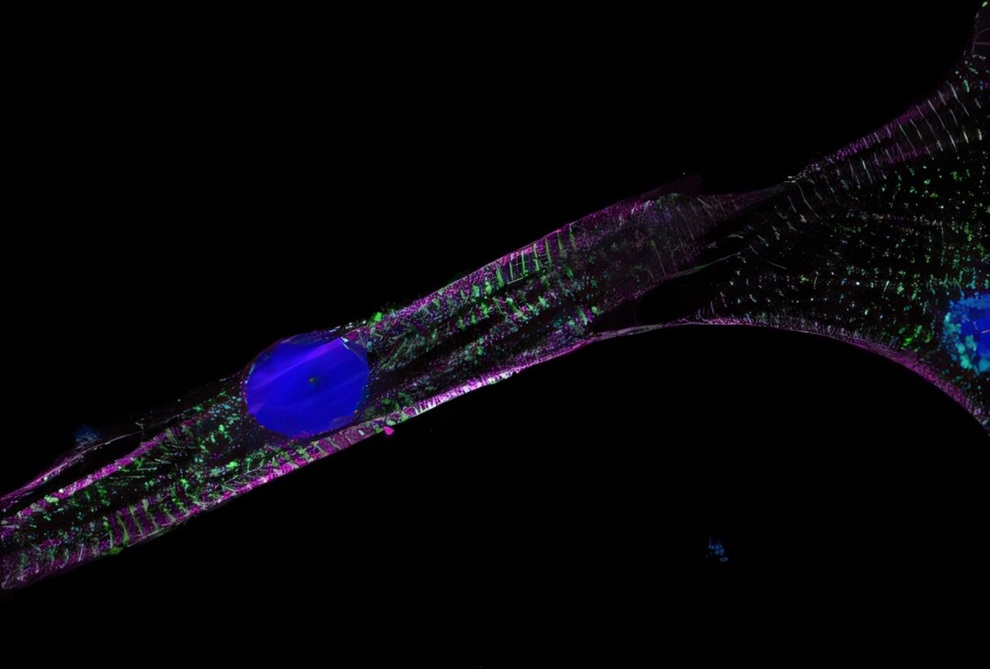
Los resultados revelaron que las células cardíacas que sobrevivieron al tratamiento con doxorrubicina carecían de un gen llamado CA12, responsable de catalizar reacciones que involucran dióxido de carbono, lo que ayuda a regular funciones corporales esenciales como la respiración y la producción de saliva. Pruebas genéticas posteriores confirmaron su hipótesis: cuando se eliminó el CA12 de las células cardíacas, se volvieron resistentes al daño inducido por la doxorrubicina. Si bien aún no se comprende por completo el papel exacto del CA12 durante el tratamiento con doxorrubicina, los investigadores están trabajando para averiguar su función. Una vez que se identificó al CA12 como un factor crítico en la toxicidad de la doxorrubicina, el equipo buscó una forma de evitar que la proteína CA12 causara daño a las células cardíacas. Seleccionaron 40 medicamentos que se sabe que inhiben las proteínas de la anhidrasa carbónica como el CA12 y los probaron junto con la doxorrubicina en células cardíacas. Al comparar las tasas de supervivencia de estas células, identificaron qué medicamentos ayudaron a las células a sobrevivir al tratamiento.
Su investigación, publicada en Cell Stem, descubrió que un fármaco llamado indisulam, que actualmente se está estudiando como un posible tratamiento contra el cáncer, ayudó a las células cardíacas a sobrevivir a la toxicidad de la doxorrubicina. El indisulam protegió la capacidad de las células cardíacas para contraerse y relajarse, manteniendo las funciones celulares esenciales. La siguiente fase de la investigación implicó probar el indisulam en organismos vivos. Se trató a los ratones con doxorrubicina y luego se les administró indisulam o un control. Los ratones que recibieron indisulam junto con doxorrubicina mostraron una mejor función cardíaca, menos atrofia cardíaca y una estructura celular cardíaca mejor mantenida. Los investigadores ahora se centran en comprender cómo el indisulam bloquea la actividad de CA12 y planean realizar más pruebas para reducir la toxicidad de la doxorrubicina. Además, pretenden explorar cómo varios genes trabajan juntos para causar daño a las células cardíacas, en lugar de centrarse en un gen a la vez. El equipo tiene planes ambiciosos para su herramienta de detección basada en CRISPR y pretende aplicarla más allá de la toxicidad de las células cardíacas en estudios futuros.
“Esta prueba CRISPR es una herramienta válida para el descubrimiento de fármacos. Para mí, esa es la principal conclusión del estudio”, afirmó el Dr. Joseph Wu, profesor de medicina cardiovascular y director del Instituto Cardiovascular de Stanford. “Es una prueba de principio. En el futuro, se podría utilizar para otros tipos de toxicidad o enfermedades. Creemos que es una herramienta muy poderosa”.