Protocolo ultrasensible detecta proteínas de enfermedad de Parkinson en vesículas extracelulares de la sangre
Actualizado el 05 Nov 2024
Los trastornos cerebrales como la enfermedad de Parkinson (EP) y la enfermedad de Alzheimer (EA) suelen comenzar a desarrollarse mucho antes de la aparición de síntomas clínicos perceptibles. Una intervención temprana podría ralentizar o detener la progresión de la enfermedad, pero los métodos actuales no permiten el diagnóstico de estos trastornos en etapas presintomáticas. Por ejemplo, las lesiones cerebrales específicas asociadas con la EP solo pueden identificarse mediante biopsias cerebrales, que suelen realizarse póstumamente. Para abordar este importante desafío, los investigadores están explorando el concepto de "biopsias líquidas", que facilitan la extracción no invasiva de sangre u otros fluidos corporales para el análisis de moléculas derivadas del cerebro y otros tejidos sólidos.
Un objetivo especialmente prometedor en los fluidos corporales son las “vesículas extracelulares” (VE), que son pequeños sacos rodeados de membranas que las células cerebrales y otros tipos de células liberan en los fluidos circundantes. Estas vesículas contienen varias moléculas que pueden ser específicas de los tipos de células que las producen, incluidas las del cerebro, y que podrían servir como biomarcadores protegidos para la detección temprana del Parkinson y otras enfermedades neurológicas. A pesar de los avances recientes, los expertos en investigación de las VE han tenido dificultades para determinar si las moléculas de biomarcadores específicos medidas en las VE aisladas están estrictamente contenidas dentro de estas vesículas o simplemente unidas a su superficie. Esta incertidumbre ha obstaculizado su capacidad para extraer conclusiones claras sobre las moléculas de carga presentes en las VE de varios tejidos.
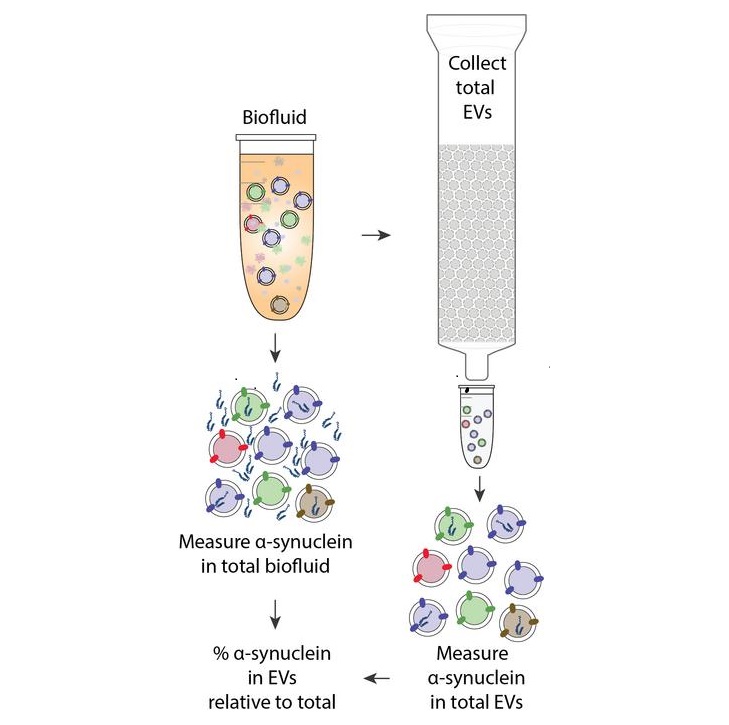
Ahora, un equipo de investigación colaborativo, que incluye científicos del Instituto Wyss de la Universidad de Harvard (Boston, MA, EUA), ha abordado esta cuestión incorporando un paso vital en un protocolo ultrasensible ya validado. Al digerir enzimáticamente todas las proteínas unidas a la superficie de una población de VE purificada, se centraron con éxito en la carga protegida dentro de las VE mientras eliminaban contaminantes no específicos. Utilizando su protocolo mejorado para medir el biomarcador de la EP ⍺-sinucleína en sangre, los investigadores pudieron diferenciar con precisión la pequeña fracción de proteína contenida en las VE de la cantidad total presente en el plasma sanguíneo por primera vez. En particular, combinaron este avance con un ensayo de detección ultrasensible recientemente desarrollado para una forma fosforilada de ⍺-sinucleína, que aumenta durante la progresión de la EP y la demencia por cuerpos de Lewy relacionada. Después de analizar una cohorte de muestras de pacientes, los investigadores encontraron un enriquecimiento de la proteína patológica ⍺-sinucleína dentro de las VE en comparación con el plasma total. Estos hallazgos se han publicado en Proceedings of the National Academy of Sciences (PNAS).
“La investigación sobre las VE en nuestro grupo y en otros durante las últimas décadas ha hecho avanzar de manera constante nuestra comprensión de su compleja biología y composición molecular. Sin embargo, el aislamiento de VE puras y específicas de tejido a partir de fluidos corporales como la sangre o el líquido cefalorraquídeo que rodea el sistema nervioso central, incluido el cerebro, y la validación y cuantificación de su verdadero contenido con mediciones precisas aún presentan desafíos técnicos formidables”, dijo David Walt, Ph.D. del Instituto Wyss de la Universidad de Harvard, quien dirigió el equipo de investigación. “Nuestro trabajo reciente está proporcionando una solución para ayudar a llenar este vacío tecnológico y nos acerca a poder obtener VE libres de contaminación para usarlas como fuentes ricas en biomarcadores clínicos, como demostramos con el ejemplo de la β-sinucleína fosforilada”.