Identifican mutaciones genéticas que causan síndrome CFZ
Por el equipo editorial de LabMedica en español
Actualizado el 27 Jul 2017
Los investigadores han identificado mutaciones genéticas que causan, a través de un defecto en la fusión de los mioblastos, el síndrome muscular heredado, poco frecuente, de Carey-Fineman-Ziter (CFZS) y han descubierto también un mecanismo subyacente para el desarrollo muscular.Actualizado el 27 Jul 2017
El CFZS es una miopatía congénita caracterizada por debilidad facial, mentón pequeño o retraído, paladar hendido y escoliosis, entre otros síntomas. Los investigadores, un equipo de colaboradores de varias instituciones, encontraron que las mutaciones funcionales en el gen para el miomarcador de la proteína (MYMK), causan el CFZS. El gen MYMK es necesario para la fusión de las células de mioblastos en miotubos (fibras musculares), durante el desarrollo embrionario y para la regeneración de las células musculares después de las lesiones.
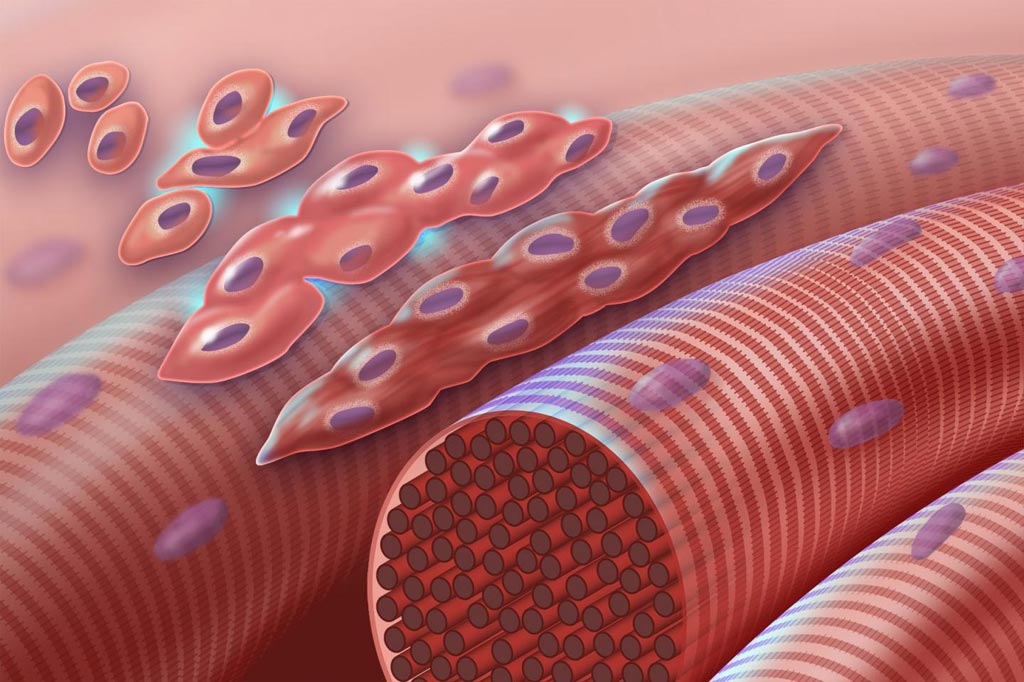
Imagen: Fusión de mioblastos. Este gráfico representa mioblastos normales (células musculares tempranas con un único núcleo) que se fusionan para formar miocitos (células musculares multinucleadas) durante la miogénesis. En el síndrome de Carey-Fineman-Ziter esta cascada se interrumpe debido a un defecto en el miomarcador de la proteína de membrana (MYMK) requerido para la fusión célula-célula (Fotografía cortesía de Darryl Leja, NHGRI).
“Los avances en tecnología de genómica y el poder de la ciencia de equipo nos han permitido identificar la causa de esta enfermedad muy rara, 35 años después de que fue descrita por primera vez por el Dr. John Carey y colegas de la Universidad de Utah”, dijo el coautor del estudio, Francis S. Collins, MD, PhD, director de los Institutos Nacionales de la Salud (NIH).
Las personas afectadas con CFZS a veces han sido mal diagnosticadas con el síndrome de Moebius, otro trastorno muy raro, caracterizado por la parálisis facial. “Este descubrimiento mejorará la capacidad de los médicos para diagnosticar esta enfermedad y ofrecerá a las familias un asesoramiento genético y un tratamiento exactos”, dijo la colíder del estudio, Irini Manoli, MD, PhD, científica médica y miembro del personal clínico del Instituto Nacional de Investigación del Genoma Humano de los NIH (NHGRI Bethesda , MD, EUA).
“Además,” dijo la Dra. Manoli, “este raro síndrome genético proporciona nuevas perspectivas sobre los efectos del desarrollo muscular en la formación de huesos craneofaciales y esqueléticos” --abriendo un nuevo camino de exploración y desarrollo para las herramientas de regeneración muscular.
El objetivo del estudio fue aprender más sobre la genética y las características clínicas del síndrome de Moebius y otros trastornos congénitos de la debilidad facial. El Consorcio de Investigación del Síndrome de Moebius trajo 63 pacientes y sus familias, para poder realizarles evaluaciones detalladas de múltiples sistemas, incluyendo estudios de imágenes cerebrales y musculares y biopsias musculares. Los investigadores colaboraron a través de las Oportunidades para la Investigación Colaborativa en el Centro Clínico de los NIH, un nuevo mecanismo de financiación que anima a los investigadores intramuros y extramuros a trabajar juntos.
Los investigadores realizaron fenotipificaciones detalladas y emplearon la secuenciación del exoma a partir del ADN de la sangre en hermanos afectados de 3 familias no relacionadas, así como una biopsia muscular en uno de los individuos afectados. Para identificar las mutaciones genómicas asociadas con el CFZS, tres laboratorios – separados, el uno de Elizabeth Engle, MD, del Hospital Infantil de Boston (EUA), el otro de Stephen Robertson, MD, de la Universidad de Otago (Nueva Zelanda) y el de John Carey, MD, de la Universidad de Utah (EE. UU.) -- analizaron los datos de la secuencia del exoma de cada una de las 3 familias.
Entre los genes que albergaban mutaciones identificadas en cada familia, sólo el gen de MYMK era común a los tres. Un modelo de ratón con inactivación (knock-out) del gen MYMK, muestra una completa falta de desarrollo muscular, lo que lleva a la muerte temprana de los ratones recién nacidos, convirtiendo al gen mymk en un buen candidato para estudios posteriores. Utilizando la tecnología CRISPR-Cas9, un equipo dirigido por el primer autor, Silvio Alessandro Di Gioia, PhD, y el Dr. Engle generaron peces cebra, con mutación en mymk. El pez cebra mutante afectado era más pequeño y tenía un desarrollo muscular anormal y deformidades de la mandíbula, que se parecían al fenotipo del paciente. Luego realizaron estudios funcionales sobre la gravedad de cada una de las mutaciones genómicas.
Ellos fueron capaces de corregir los músculos afectados en el pez cebra mediante la inyección de la proteína MYMK humana normal en el pez mutante, un éxito que da esperanzas para restaurar la función de MYMK en los músculos como un tratamiento para el CFZS y para reducir potencialmente las características progresivas de este trastorno.
Sólo ocho personas en todo el mundo han sido diagnosticadas con el CFZS con mutaciones en MYMK. Ahora se puede agregar mymk a los paneles de genes de diagnóstico de las miopatías congénitas, lo que mejorará el diagnóstico y añadirá a la comprensión del espectro de la gravedad de la enfermedad y el resultado.
El estudio fue publicado el 6 de julio de 2017, en la revista Nature Communications.













