Kit 1copy COVID-19 qPCR Multi de 1 drop recibe autorización para uso en emergencias de la FDA
Por el equipo editorial de LabMedica en español
Actualizado el 15 May 2020
1drop Inc. (Gyeonggi-do, Corea) obtuvo la autorización de uso en emergencias (AUE) de la Administración de Medicamentos y Alimentos de los Estados Unidos (FDA) para el kit 1copy COVID-19 qPCR Multi de la compañía.Actualizado el 15 May 2020
El kit 1copy COVID-19 qPCR Multi permite la detección cualitativa del SARS-CoV-2 mediante la amplificación de dos genes objetivo (gen E y gen RdRp) del virus que causa la COVID-19 con qPCR en tiempo real (incluida la reacción de transcripción inversa) a través de ARN extraído de muestras clínicas (hisopos nasofaríngeos o hisopos orofaríngeos) de pacientes con sospecha de enfermedad infecciosa respiratoria. RdRp es el objetivo de detección específico del SARS-CoV-2, y el gen E es el objetivo de detección específico para los coronavirus beta.
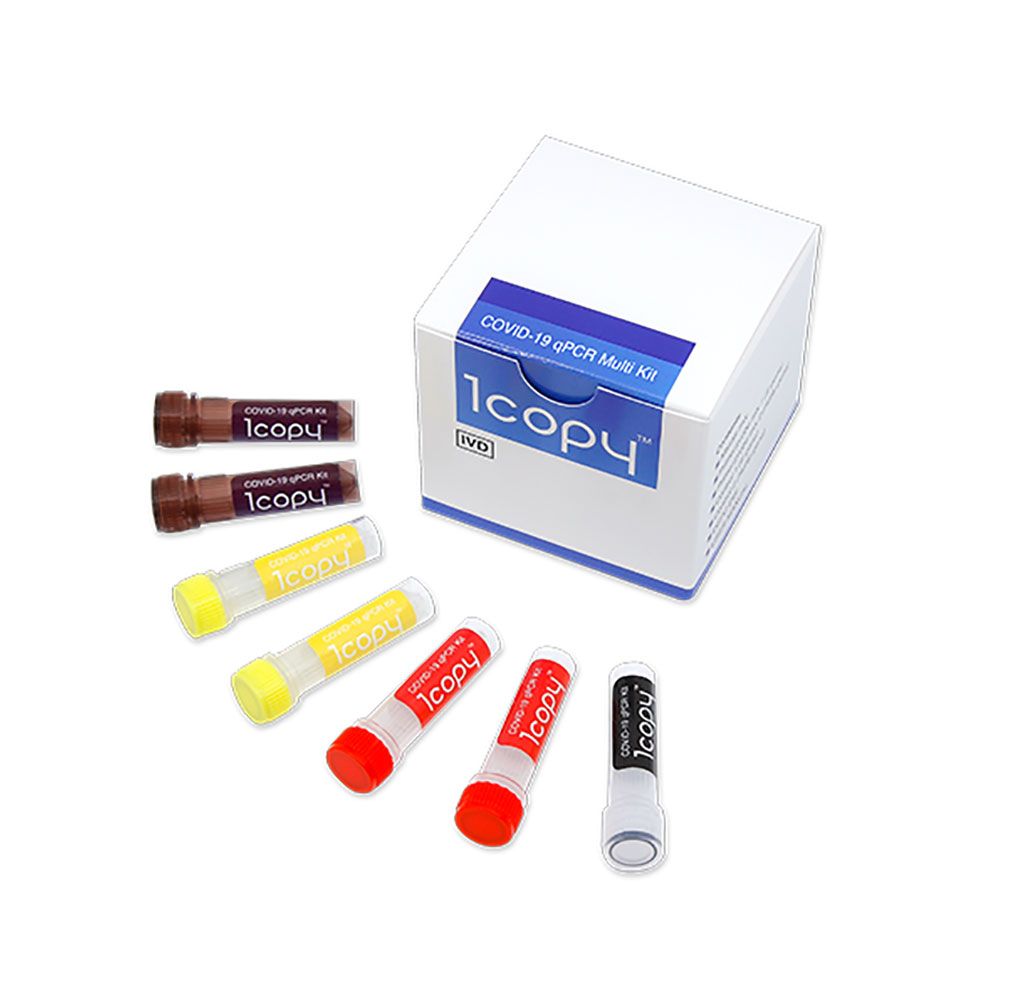
Imagen: Kit 1copy COVID-19 qPCR Multi (Fotografía cortesía de 1drop Inc.)
Además de su sensibilidad extremadamente alta (límite de detección de 200 copias por ml), el kit de PCR tiene un tiempo de medición corto que permite obtener resultados en menos de dos horas. Los hospitales y laboratorios de referencia pueden procesar el nuevo ensayo en una amplia gama de instrumentos de PCR en tiempo real que están ampliamente disponibles en todo el mundo. El kit 1copy COVID-19 qPCR Multi fue aprobado y/o comercializado en varios países, incluidos Alemania, Corea del Sur, Sri Lanka, Luxemburgo, Paraguay, Georgia, Bulgaria y Canadá.
Enlace relacionado:
1drop Inc.