La prueba de diagnóstico de PCR QuantiVirus de DiaCarta recibe autorización de uso en emergencias de la FDA de los EUA
Por el equipo editorial de LabMedica en español
Actualizado el 18 Apr 2020
DiaCarta Inc. (Richmond, CA, EUA), una compañía de diagnósticos moleculares de precisión, obtuvo la Autorización para Uso en Emergencias de la FDA de los EUA para su prueba de diagnóstico de PCR QuantiVirus™ (Dx) patentada, que detecta específicamente tres genes diferentes del SARS-CoV-2. DiaCarta también recibió la marca de Conformitè Europëenne (CE) para el producto. Recientemente, la compañía expandió su capacidad de fabricación a 500.000 pruebas por semana y planea expandirse a una fabricación aún más grande (4x) a fin de satisfacer la creciente demanda de pruebas de PCR para monitorizar la COVID-19.Actualizado el 18 Apr 2020
La prueba QuantiVirus™ detecta todas las cepas actualmente conocidas de SARS-CoV-2 en hisopados nasofaríngeos, hisopados orofaríngeos y muestras de esputo. Los tres genes codificados por el ARN viral son los genes N, Orf1ab y E, detectados por el ensayo cuantitativo de PCR en tiempo real, de transcriptasa inversa, que permite una alta sensibilidad y especificidad con un límite de detección de 100 copias/mL sin ninguna reactividad cruzada detectable con otros patógenos de las vías respiratorias humanas. Los usuarios, incluidos los laboratorios de referencia de los Estados Unidos y los hospitales con laboratorios de diagnóstico molecular de alta complejidad, ahora pueden usar los kits QuantiVirus™ para detectar el SARS-CoV-2 dentro de las dos horas posteriores a la extracción de ARN.
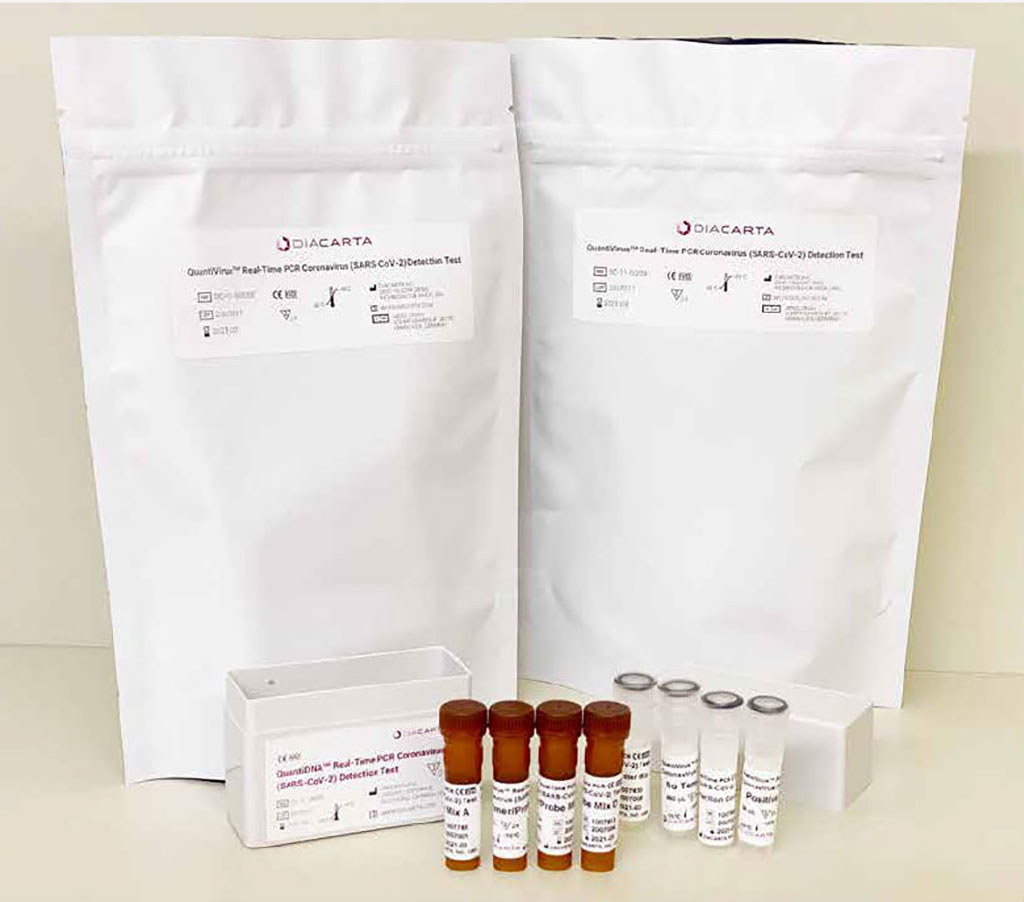
Imagen: Prueba diagnóstica de PCR QuantiVirus de DiaCarta (Fotografía cortesía de DiaCarta Inc.)
“Ya apoyamos a los laboratorios en los EUA y en el extranjero para satisfacer sus necesidades crecientes de análisis, dado que nuestro kit de reactivos de diagnóstico se puede usar con instrumentos de PCR comúnmente disponibles, como el Applied Biosystems 7500 y el QuantStudio 5”, dijo Ram Vairavan PhD, vicepresidente senior de DiaCarta. “Hemos validado esta prueba diagnóstica en nuestro laboratorio CLIA y podemos atender las necesidades actuales de organizaciones globales que ofrecen las pruebas de SARS-CoV-2 a los proveedores de primera línea”.
Enlace relacionado:
DiaCarta Inc.










 (3) (1).png)